Восстановление - двуокись - углерод
Cтраница 1
Восстановление двуокиси углерода сочетается с рекомбинацией половины первичных фотохимических продуктов. [1]
Восстановление двуокиси углерода с помощью LiAlH4 может привести к образованию трех продуктов реакции. [2]
Восстановление двуокиси углерода заканчивается на расстоянии примерно 1 - 1 5 м от фурм. [3]
Восстановление двуокиси углерода зелеными растениями является самым крупным из химических процессов на Земле. Чтобы яснее представить, что значит ежегодная продукция в 10 т, ее можно сравнить с общей продукцией металлургической, химической и горной индустрии, выражаемой величиной порядка 109 т в год. Точно так же весьма убедительно сравнение энергии, ежегодно накопляемой растениями, с энергией, доставляемой иными путями. [4]
Реакции восстановления двуокиси углерода протекают через ряд стадий. [5]
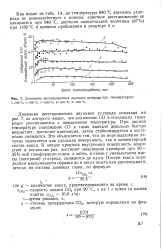 |
Динамика восстановления двуокиси углерода при температурах. / - 940 С. 2 - 990 С. 3 - 1050 С. 4 10Ю С. S-1150 С. [6] |
Динамика восстановления двуокиси углерода показана на рис. 7, из которого видно, что количество СО в отходящих газах резко увеличивается с повышением температуры. При данной температуре содержание СО в газах вначале довольно быстро возрастает, достигает максимума, затем стабилизируется и постепенно снижается. Это объясняется тем, что по мере выделения летучих изменяется как удельная поверхность, так и элементарный состав кокса. В начале процесса внутренняя поверхность возрастает в несколько раз, достигает максимума примерно при 30 - 35 % - ной газификации кокса, а затем, в связи с уменьшением массы ( потерями) углерода, снижается до нуля. [7]
Эндотермическая реакция восстановления двуокиси углерода до окиси углерода в, присутствии углерода позволяет отвести часть тепла, а также заметно снизить расход генераторного газа. [8]
Скорость реакции восстановления двуокиси углерода, как и всякой другой химической реакции, определяется как химической кинетикой, так и диффузией. В кислородной зоне диффузионным фактором реакции восстановления можно пренебречь, ввиду того, что эта реакция, имея своим источником появление окисла С02 непосредственно на поверхности и даже в порах угольных частиц, почти не ограничена скоростью подвода реагента. Напротив, комплекс реакций, связанных с образованием первичных окислов СО и СО, должен более или менее тормозиться диффузией кислорода из объема между частицами к реагирующей поверхности. Далее, по мере накопления С02 в объеме каналов между частицами протекает и диффузия С02 к стенкам угольных частиц. [9]
Для реакции восстановления двуокиси углерода была получена следующая зависимость ( см. гл. [10]
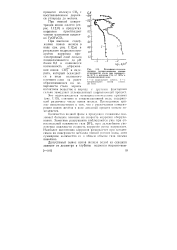 |
Потенциостатические анодные поляризационные кривые углеродистой стали при температуре 80 С и давлении СО2 0 7 МПа в конденсационной воде. [11] |
СОг с восстановлением двуокиси углерода до метана. [12]
Эти реакции представляют собой истинное восстановление двуокиси углерода и окисление донора RH или воды. Реакции типа (8.30) предложены Вилыптеттером и Штолем [15] как основные стадии фотосинтеза. [13]
Природа первичного продукта восстановления двуокиси углерода не установлена с полной достоверностью, но он, по-видимому, весьма близок к с-глицериновой кислоте ( см. также разд. [14]
Природа первичного продукта восстановления двуокиси углерода не установлена с полной достоверностью, но он, по-видимому, весьма близок к в-глицериновой кислоте ( см. также разд. [15]
Страницы: 1 2 3 4