Кинетическое кривое восстановление
Cтраница 1
 |
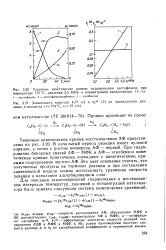
Кинетические кривые гидрирования нитробензола при различных навесках гидрируемого вещества. [1] |
Кинетические кривые восстановления нитробензола на испытуемых катализаторах по форме аналогичны тем, которые получены Д. В. Сокольским и В. П. Шмониной [9] при изучении гидрирования нитробензола на скелетном никеле. [2]
Типичные кинетические кривые восстановления АФ представлены на рис. 3.20. В начальный период реакция имеет нулевой: порядок, а затем с ростом конверсии АФ - первый. При гидрировании бинарных смесей АФ - МФК и АФ - этилбензол кинетические кривые практически совпадают с кинетическими кривыми гидрирования чистого АФ. Это дает основание считать, что получаемые продукты не тормозят реакции и при составлении кинетической модели можно использовать уравнение скорости реакции в идеальном адсорбированном слое. [4]
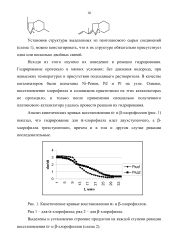
Анализ кинетических кривых восстановления ос - и ( 3-хлорофиллов ( рис. 1) показал, что гидрирование для ос-хлорофилла идет двухступенчато, а ( 3-хлорофилла трехступенчато, причем и в том и другом случае реакции последовательные. [6]
 |
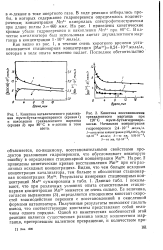
Восстановление нитрозобензола, фенилгидроксиламина и их смесей на скелетном никеле в 50 % - ном спирте при температуре 25 С. [7] |
На кинетических кривых восстановления смеси, составленной из эквимолекулярных количеств нитрозобензола и фенилгидроксиламина ( кривая / / / рис. 6), и смеси, в которой фенилгидрокси-ламин брался в два раза большем количестве, чем нитрозобензол ( кривая V рис. 6), исчез участок возрастающей скорости, столь характерный для кинетической кривой восстановления индивидуального нитрозобензола в нейтральной среде. В том случае, когда фенилгидроксиламина было взято в два раза меньше, чем нитрозобензола ( кривая / V), участок возрастающей скорости сохранился, но значение скорости на этом участке значительно увеличилось. [8]
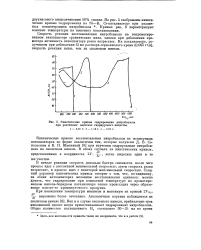
Если сравнить кинетические кривые восстановления нитробензола при 5 в щелочной ( рис. 2) и нейтральной ( рис. 4) среде, то можно видеть, что присутствие щелочи отражается не только на продолжительности процесса, но также и на характере кинетической кривой. В присутствии щелочи кривая имеет изломы, проходит через минимум и максимум. [9]
 |
Схема экспериментальной установки. [10] |
Были сняты кинетические кривые восстановления двуокиси гафния, двуокси циркония и пятиокиси тантала различными восстановителями при разных температурах. [11]
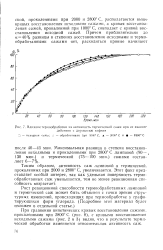 |
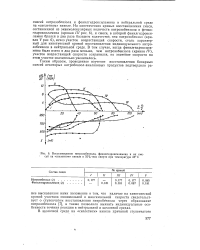
Влияние термообработки па активность термической сажи при ее взаимодействии с двуокисью гафния. [12] |
При сравнении кинетических кривых восстановления сажами, прокаленными при 2800 С ( рис. 8), с кривыми восстановления исходными сажами ( рис. 2 и 3) видно, что в результате термической обработки изменяется относительная активность саж. [13]
На рис. 2 приведены кинетические кривые восстановления Мп3 при его различных исходных концентрациях. Данные табл. 1 показывают, что при различных условиях опыта относительная стационарная концентрация Мп3 меняется не очень сильно. Ее величина, согласно выражению ( 3), определяется отношением констант скоростей взаимодействия перекиси с восстановленной и окисленной формами катализатора. Полученные результаты позволяют сделать вывод, что соответствующие константы представляют собой величины одного порядка. [15]
Страницы: 1 2