Iva-подгруппа
Cтраница 1
Элемент IVA-подгруппы кремний отличается от углерода меньшим значением электроотрицательности, что связано с меньшей прочностью связи электронов наружного уровня в атоме. Как и углерод, кремний отличается от других неметаллических элементов неспособностью к образованию элементарных отрицательно ( равно как и положительно) заряженных ионов и потому, так же как и бор, относится к классу промежуточных элементов. [1]
Элементы IVA-подгруппы отличаются друг от друга больше, чем элементы ША-подгруппы. [2]
К IVA-подгруппе относятся - элементы: углерод, кремний, германий, олово и свинец. [3]
К IVA-подгруппе периодической системы относятся типические элементы - углерод С, кремний Si и элементы подгруппы германия - германий Ge, олово Sn, свинец РЬ. [4]
Из элементов IVA-подгруппы в свободном состоянии встречается только углерод. [5]
К металлам IVA-подгруппы относятся олово Sn, свинец РЬ. [6]
Атомы элементов IVA-подгруппы имеют на наружном энергетическом уровне по четыре электрона - два на s - и два на р-орбита-лях. В нормальном состоянии они двухвалентны. [7]
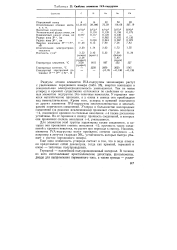 |
Свойства элементов IVA-подгруппы. [8] |
Радиусы атомов элементов IVA-подгруппы закономерно растут с увеличением порядкового номера ( табл. 25), энергия ионизации и относительная электроотрицательность уменьшаются. Тем не менее углерод и кремний существенно отличаются по свойствам от остальных элементов подгруппы. У германия имеются металлические признаки, а у олова и свинца они преобладают над неметаллическими. Кроме того, углерод и кремний отличаются от других элементов IVA-подгруппы многочисленностью и многообразием химических соединений. Углерод в большинстве кислородных соединений ( за редкими исключениями) проявляет степень окисления 4, соединения кремния со степенью окисления 4 также достаточно устойчивы. Но от германия к свинцу прочность соединений, в которых они проявляют степень окисления 4, уменьшается. [9]
Элементы IIIA - и IVA-подгрупп, а также бериллий образуют ковалентные фосфиды. [10]
По химическим свойствам элементы IVA-подгруппы весьма разнообразны - от ярко выраженного неметаллического элемента углерода до типичного металла - свинца. [11]
Она появляется у элементарных веществ в IVA-подгруппе, с увеличением порядкового номера элементов возрастает и достигает максимальных значений в VIIA-подгруппе, после чего снижается до нуля. В подгруппах IVA-VIIA значения окислительной активности с увеличением порядкового номера элементов снижаются. [12]
Она появляется у элементарных веществ в IVA-подгруппе, с увеличением порядкового номера элементов возрастает и достигает максимальных значений в VIIА - подгруппе, после чего снижается до нуля. В подгруппах IVA - VIIА значения окислительной активности с увеличением порядкового номера элементов снижаются. [13]
Таким образом, структуру молекул водородных соединений элементов IVA-подгруппы, воды, аммиака и многих других молекул невозможно объяснить исходя только из положений метода валентных связей. Для объяснения геометрии этих молекул привлекается концепция гибридизации атомных орбиталей. Суть концепции гибридизации атомных ор-биталей заключается в том, что атомные орбитали могут геометрически видоизменяться и смешиваться друг с другом таким образом, чтобы обеспечить наибольшее перекрывание с орбиталями других атомов и, следовательно, наибольший выигрыш энергии. Это достигается в том случае, если вместо орбиталей, имеющих разные форму и энергию, появляются одинаковые по форме и энергии гибридные орбитали, представляющие собой линейные комбинации исходных атомных орбиталей. [14]
Как видно из формул, для нормального состояния атомов элементов IVA-подгруппы характерно наличие двух одиночных электронов на наружном уровне. Преднаружный уровень электронной оболочки атома углерода в отличие от остальных элементов содержит два электрона. Такая особенность сказывается на некоторых свойствах углерода. [15]
Страницы: 1 2