Сульфид - тяжелый металл
Cтраница 1
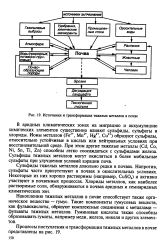 |
Источники и трансформация тяжелых металлов в почве. [1] |
Сульфиды тяжелых металлов довольно редки в почвах. Напротив, сульфаты часто присутствуют в почвах в окислительных условиях. Некоторые из них хорошо растворимы ( например, CuSO4) и активно участвуют в почвенных процессах. Хлориды металлов, как наиболее растворимые соли, обнаруживаются в почвах аридных и семиаридных климатических зон. [2]
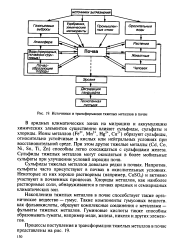 |
Источники и трансформация тяжелых металлов в почве. [3] |
Сульфиды тяжелых металлов довольно редки в почвах. [4]
Сульфиды тяжелых металлов настолько мало растворимы в воде, что гидролиз не может происходить. Большинство из них окрашено, в то время как сульфиды щелочных и щелочноземельных металлов бесцветны. [5]
Сульфиды тяжелых металлов малорастворимы в воде, имеют характерную окраску: сульфид цинка ZnS - белую, меди CuS - черную, кадмия CdS - желтую, ртути HgS - красную. Благодаря этому они служат основой для изготовления красок ( в том числе люминофоров), используются в качественном анализе. Сульфиды калия, кальция и бария применяют в кожевенном производстве для удаления шерсти со шкур. [6]
Сульфиды тяжелых металлов малорастворимы в воде, имеют характерную окраску: сульфид цинка ZnS - белого, меди CuS - черного, кадмия CdS - желтого, ртути HgS - красного цвета. Сульфиды калия, кальция и бария используют в кожевенном производстве для удаления шерсти со шкур. [7]
Многие сульфиды тяжелых металлов имеют необычные физические свойства, о которых здесь можно только упомянуть. Некоторые из этих свойств ярче выражены в селени-дах и теллуридах, которые во многих отношениях еще больше приближаются к сплавам. Многие твердые вещества ( кроме металлов) при обычных температурах слабо проводят электрический ток, причем их электропроводность стремится к нулю при понижении температуры, в противоположность поведению металлов. [8]
Большинство сульфидов тяжелых металлов настолько мало растворимы в воде, что гидролитического расщепления их не происходит. Некоторые сульфиды разбавленными сильными кислотами не разлагаются. Произведение растворимости этих сульфидов настолько мало, что даже при понижении концентрации ионов S в растворе за счет прибавления ионов Н концентрация ионов металла в растворе, находящемся в равновесии с сульфидом ( донной фазой), очень незначительна. [9]
Большую роль играют сульфиды тяжелых металлов в основной химической промышленности как сырье для получения серной кислоты и ее солей. [10]
 |
Произведение растворимости гидроксидов и сульфидов меди, никеля, цинка и свинца. [11] |
Поскольку гидроксиды и сульфиды тяжелых металлов образуют устойчивые коллоидные системы для интенсификации процесса их осаждения в сточные воды необходимо вводить коагулянты и флокулянты. Коллоидные частицы сульфидов имеют отрицательный заряд, поэтому для коагуляции сульфидов используют электролиты с многозарядными катионами - обычно сульфаты алюминия или трехвалентного железа. При коагуляции гидроксидов требуется электролит с многозарядными анионами, так как коллоидные частицы заряжены положительно. Хорошими коагулянтами гидроксидов являются сульфат-ионы. Помимо электролитной коагуляции на практике часто используют взаимную коагуляцию коллоидных растворов с противоположным зарядом частиц. [12]
К ним относятся сульфиды малоактивных тяжелых металлов. [13]
Простейший метод синтеза сульфидов тяжелых металлов за ключается в осаждении их из растворов солей металлов под. При этом получают соединения в мелкодисперсном, зачастую даже в коллоидном состоянии, в то время как при проведении реакции в газовой фазе часто образуются кристаллические сульфиды. [14]
Хотя молекулярная растворимость сульфидов тяжелых металлов не определялась, верхние пределы ее можно ориентировочно оценить. [15]
Страницы: 1 2 3 4