Сульфид - щелочноземельный металл
Cтраница 1
Сульфиды щелочноземельных металлов Э8 представляют собой белые твердые вещества. Они входят в состав светящихся ( фосфоресцирующих) веществ. [1]
Сульфиды щелочноземельных металлов получают сульфированием карбонатов металлов смесью серы и крахмала в присутствии различных солевых смесей или сульфированием окислов сероуглеродом [ 3, с. Теллурид цинка и кадмия синтезируют в основном методом сплавления компонентов [ 5, с. Известен способ получения бинарных соединений из паров компонентов, пригодный для всех халькогенидов элементов II группы [7], но он еще не нашел широкого применения. [2]
Сульфиды щелочноземельных металлов в водном растворе практически нацело гидролизуются. В результате гидролиза получаются хорошо растворимые гидросульфиды. [3]
Сульфиды щелочноземельных металлов термически устойчивы, так как их теплоты образования достаточно высоки. [4]
На воздухе сульфиды щелочноземельных металлов окисляются. Пропусканием струи воздуха сквозь водную суспензию CaS по реакции 2Са8 НгО 2Ог Са ( ОН) а Са52Оз может быть получен тиосульфат кальция. Он очень хорошо растворим в воде. При переходе к стронцию и затем барию растворимость тиосуль-фатов сильно снижается ( ср. [5]
На воздухе сульфиды щелочноземельных металлов окисляются. Пропусканием струи воздуха сквозь водную суспензию CaS по реакции 2CaS Н2О - f - 2О2 Ca ( OH) 2 CaSjO3 может быть получен тиосульфат кальция. Он очень хорошо растворим в воде. При переходе к стронцию и затем барию растворимость тиосуль-фатов сильно снижается ( ср. [6]
Ширина запрещенной зоны сульфидов щелочноземельных металлов не измерена, но по данным Лендера [118], она значительно больше 3 эв. [7]
Люминофоры на основе сульфидов щелочноземельных металлов имеют глубокие электронные ловушки, что позволяет получать наиболее длительное послесвечение. В качестве активаторов в этих люминофорах используют тяжелые металлы Bi, Си, РЬ, Ми, а также редкоземельные элементы. Основной недостаток люминофоров на основе сульфидов щелочноземельных металлов - их гидролитическое разложение влагой воздуха, при котором теряются их люминесцентные свойства. [8]
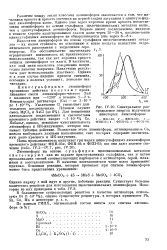 |
Спектральное распределение энергии излучения некоторых люминофоров. [9] |
Люминофоры на основе сульфидов щелочноземельных металлов синтезируют как из заранее приготовленных сульфидов, так и путем прокаливания смесей соответствующих карбонатов с активатором, серой, плавнями и восстановителем. В качестве восстановителя чаще всего применяют крахмал. [10]
При масс-спектрометр ическом изучении сульфидов щелочноземельных металлов [116] вычислена энергия диссоциации SrS в газообразном состоянии, равная 74 1 4 5 ккал / моль, и теплота испарения, равная 148 0 5 ккал / моль. [11]
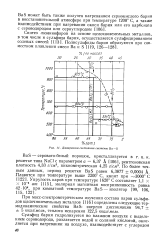 |
Диаграмма состояния системы Ва - S. [12] |
При масс-спектрометрическом изучении состава паров сульфидов щелочноземельных металлов [116] определены следующие термодинамические свойства BaS: энергия диссоциации 94 7 5 ккал / моль, теплота испарения 122 5 ккал / моль. [13]
Этот же метод используют для получения сульфидов щелочноземельных металлов. [14]
При использовании в качестве восстановителя сульфитов и сульфидов щелочноземельных металлов ( Са, Ва) образуются труднорастворимые сульфаты; после того как они выпадают в осадок, получается чистый раствор бромистой соли. Применение растворов сульфитов и тиосульфатов щелочных металлов нерационально, поскольку продукты реакций нужно подвергать раскристал-лизации. [15]
Страницы: 1 2 3 4