Сульфитоксидаза
Cтраница 1
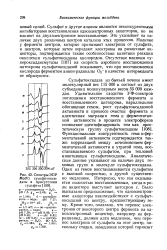 |
Спектры ЭПР Mo ( V сульфитоксидазы в присутствии сульфита. [1] |
Сульфитоксидаза из бычьей печени имеет молекулярный вес 115 000 и состоит из двух субъединиц молекулярным весом 55 000 каждая. Функциональная конгруентность тема и ферментативной активности подтверждается также корреляцией между исчезновением ферментативной активности и утратой тема, восстанавливаемого сульфитом, при тепловой инактивации сульфитоксидазы. Аналитические данные указывают на наличие двух ге-мовых групп в молекуле сульфитоксидазы. Один из гемов восстанавливается сульфитом с высокой скоростью, а другой существенно медленнее. Интересно, что гем оказывается полностью восстановленным, когда в роли акцептора выступает цитохром с. Было высказано предположение, что одноэлектрон-ные акцепторы взаимодействуют с сульфитоксидазой по центру, предшествующему тему. [2]
Сульфитоксидаза превращает сульфит в сульфат и строго специфична к своему субстрату. Фермент присутствует преимущественно в печени, где он локализуется в межмембранном пространстве митохондрий. Его физиологическим акцептором электронов является митохондриальиый цитохром с. Сульфитоксидаза выделена из печени человека, крупного рогатого скота, кроликов и крыс. Она представляет собой димер, образованный двумя идентичными субъединицами с молекулярной массой 55000 - 60000, из которых каждая содержит по одному атому молибдена и одной молекуле цитохрома Ь5 - типа. [3]
Подтверждением важной роли сульфитоксидазы в организме человека является сообщение о ребенке, печень, почки и мозг которого совершенно не обнаружили сульфитоксидазной активности. [4]
Было показано, что сульфитоксидаза - простейший молиб-денсодержащий фермент, в состав которого входят только две про-стетические группы - молибденовая и гемовая. Двухэлектронный окислительный субстрат - молекулярный кислород, вероятно, связывается с гемовой группой, хотя прямых доказательств этого не получено. Сходство в спектрах ЭПР сульфитоксидазы и ксантиноксидазы указывает на общность структуры окружения молибдена в этих двух ферментах. Потребуются дальнейшие эксперименты с сульфитоксидазой того же типа, что и исследования, выполненные методом ЭПР в случае ксантиноксидазы, для того чтобы уточнить пределы аналогии в структуре этих ферментов. Анионы подавляют реакции обоих ферментов с одноэлектронными акцепторами. Причины этих эффектов пока неизвестны. [5]
В ранних работах по сульфитоксидазе имеется некоторая путаница. Позже ситуация в значительной мере прояснилась [109], однако детали механизма окисления сульфита молекулярным кислородом все еще неизвестны. [6]
Из перечисленных в табл. 20 ферментов остановимся на ксантиноксидазе и сульфитоксидазе, которые имеют существенное значение в патологии человека, а также упомянем молибденовый кофактор, содержащий молибден, железо и серу. [7]
В настоящее время известно 15 молибденсодержащих ферментов, три из которых встречаются в животном организме. Это альдегидоксидаза, ксантиноксидаза и сульфитоксидаза. В биологических системах молибден присутствует в четырех состояниях окисления ( IV-VI), из которых соединения Mo ( V) имеют отчетливый ЭПР-сигнал, легко распознаваемый по его характерной сверхтонкой структуре, содержащей шесть сателлитных пиков. [8]
Дача крысам вольфрама приводит к инактивации молибденсодержащих ферментов. Вольфрам частично замещает молибден в сульфитоксидазе, но значительная часть фермента остается полностью лишенной металла. Вольфрам в биологических системах не способен восстанавливаться, подобно молибдену, в четырехвалентную форму из пятивалентной, что, по-видимому, и является причиной инактивации им молибденсодержащих ферментов. Что же касается ксантиноксидазы, то в присутствии вольфрама образуется ее не содержащий металла апопротеид, лишенный ферментативной активности. Молибденовый кофактор восстанавливает активность обоих апопротеидов. [9]
ЭПР, типичный для аксиально симметричного поля лигандов, однако при диссоциации этой группы симметрия понижается до ромбической. Значение сверхтонкого расщепления около 1 мТ у кислой формы сульфитоксидазы ( рис. 43) указывает на то, что протон связан не непосредственно с молибденом. Изменения симметрии поля лигандов вокруг молибдена могут быть объяснены протонированием и де-протонированием одной из лигандных групп. Поскольку не обнаружено расщепления на азоте, можно предположить, что протон связан с кислородом или серой. Зависимость сигнала ЭПР Mo ( V) сульфитоксидазы от рН дает объяснение различий между спектрами фермента, восстановленного сульфитом, после введения фер-рицианида в стационарном состоянии, и спектрами, наблюдаемыми после полного восстановления феррицианида. После восстановления всего феррицианида конечный спектр ЭПР все еще характерен для кислой формы, хотя и в меньшей степени, чем стационарный спектр в ходе реакции. Возможно, что при окислении сульфита феррицианидом образуются существенные количества кислоты. [10]
Это различие может определяться большей стабилизацией парамагнитного мономерного состояния в равновесии мономер - димер в случае сульфитоксидазы или более слабым взаимодействием между Mo ( V) и другим парамагнитным центром этого фермента. Несмотря на эти количественные различия, спектры ЭПР сульфитоксидазы и ксантиноксидазы во многих отношениях сходны между собой. Спектры ЭПР обоих ферментов обнаруживают двухфазную зависимость от температуры: переход в окружении молибдена наблюдается примерно при - 113 С. Это дублетное расщепление, по-видимому, определяется взаимодействием с протоном кислотнодиссоциирующей группы. [11]
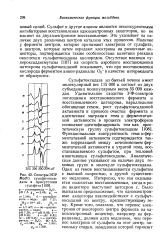 |
Спектры ЭПР Mo ( V сульфитоксидазы в присутствии сульфита. [12] |
Сульфитоксидаза из бычьей печени имеет молекулярный вес 115 000 и состоит из двух субъединиц молекулярным весом 55 000 каждая. Функциональная конгруентность тема и ферментативной активности подтверждается также корреляцией между исчезновением ферментативной активности и утратой тема, восстанавливаемого сульфитом, при тепловой инактивации сульфитоксидазы. Аналитические данные указывают на наличие двух ге-мовых групп в молекуле сульфитоксидазы. Один из гемов восстанавливается сульфитом с высокой скоростью, а другой существенно медленнее. Интересно, что гем оказывается полностью восстановленным, когда в роли акцептора выступает цитохром с. Было высказано предположение, что одноэлектрон-ные акцепторы взаимодействуют с сульфитоксидазой по центру, предшествующему тему. [13]
Было показано, что сульфитоксидаза - простейший молиб-денсодержащий фермент, в состав которого входят только две про-стетические группы - молибденовая и гемовая. Двухэлектронный окислительный субстрат - молекулярный кислород, вероятно, связывается с гемовой группой, хотя прямых доказательств этого не получено. Сходство в спектрах ЭПР сульфитоксидазы и ксантиноксидазы указывает на общность структуры окружения молибдена в этих двух ферментах. Потребуются дальнейшие эксперименты с сульфитоксидазой того же типа, что и исследования, выполненные методом ЭПР в случае ксантиноксидазы, для того чтобы уточнить пределы аналогии в структуре этих ферментов. Анионы подавляют реакции обоих ферментов с одноэлектронными акцепторами. Причины этих эффектов пока неизвестны. [14]
В этом одна из причин, которая затрудняла изучение молибденсодержащих белков. Наличие двух атомов молибдена в молекуле белка может отражать отчетливо выраженную склонность низкомолекулярных соединений молибдена к образованию димерных комплексов, однако оно может быть и случайным, поскольку ни в одном из указанных белков не обнаружено взаимодействия между атомами молибдена. Ферменты млекопитающих ( альдегидоксидаза, сульфитоксидаза, ксантиндегидроге-наза и ксантиноксидаза) выделены из печени, однако наилучшим источником ксантиноксидазы является молоко. Основным источником нитратредуктазы и нитрогеназы служат бактерии. [15]
Страницы: 1 2