Константа - скорость - образование - комплекс
Cтраница 1
 |
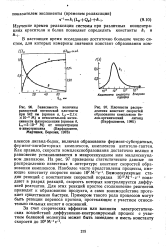
Изменение времени выжига 50 % отложенного кокса в зависимости от.| Изменение константы скорости k, образования кислород-углеродного комплекса в зависимости от содержания металла в катализаторе. [1] |
Константа скорости образования комплекса fct увеличивается по мере добавления металла и зависит от его природы. [2]
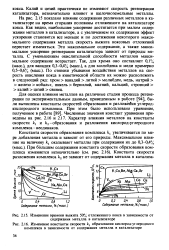
Константа скорости образования комплекса Ki увеличивается по мере добавления металлов и зависит от природы металла. Максимальное влияние на величину К оказывают концентрации металлов - примерно до 0 3 - 0 4 вес. Наиболее резко эта константа изменяется у образцов с добавками хрома; при содержании его в катализаторе от 0 1 до 0 8 % / Ci становится в 3 раза больше, чем для исходного. Среди щелочных и щелочноземельных металлов сильнее всего на константу образования комплекса влияет литий. Большая часть исследованных металлов уменьшает константу скорости Кг разложения комплекса. Так, наименьшая величина константы скорости разложения комплекса наблюдается на образцах, содержащих хром. Щелочноземельные металлы практически не влияют на койстанту разложения кислородного комплекса. [3]
 |
Изменение константы скорости с2 разложения кислород-углеродного комплекса в зависимости от содержания металла в катализаторе ( на исходном катализаторе k2 0 226. [4] |
Зависимости константы скорости образования комплекса и времени выжига 50 % кокса от природы металла имеют одинаковый характер. Это указывает на то, что влияние металлов заключается в ускорении первой стадии процесса образования кислород-углеродного комплекса вследствие их способности катализировать реакции окисления. [5]
Зависимости изменения константы скорости образования комплекса и продолжительности выжига половины отложенного кокса имеют одинаковый характер. Это показывает, что влияние металлов на выжиг коксовых отложений заключается в ускорении первой стадии процесса - образования углеродно-кислородного комплекса вследствие их способности катализировать реакции окисления. [6]
В дейтерированном растворителе константы скорости образования комплексов значительно возрастают, а константы скорости разложения уменьшаются. Если первичный изотопный эффект ассоциируется с процессом, в котором метилат формально протонируется, когда он удаляется от комплекса, то эти вторичные эффекты указывают на то, что метилат в переходном состоянии разложения только соль-ватируется. Скорость разложения комплекса 39а в воде [24], также как и 19а [218] и 50г [86], сильно катализируется кислотами. [7]
На основании результатов авторы работы приходят к выводу, что нижние пределы констант скорости образования комплексов фермента с коферментом близки к величинам, полученным независимыми ( спектрофотометрическими) методами, что подтверждает ценность кинетического метода. Снижение величины констант связано с влиянием энтропийного фактора. Это влияние в еще большей мере сказывается на последующей реакции комплекса фермент - кофермент с субстратом. [8]
Вызывает удивление вывод, что алифатические полиамины реагируют по разным механизмам [50], на основании того, что константы скорости образования комплексов порядка 2 - Ю5 - 6 - 105 л / моль-сек. Это относится даже к этилендиамину. [9]
Таким образом, измеряя парамагнитные сдвиги и времена ядерной релаксации в радикальных комплексах, можно получать информацию об их структуре, о константах равновесия, временах кизни и константах скоростей образования комплексов. [10]
На основании как полярных, так и стерических факторов энергия сольватации для таких комплексов должна уменьшаться в ряду метанол - этанол - изопропанол. Следовательно, величины констант скоростей образования комплексов также должны уменьшаться в этом ряду, что и было найдено экспериментально. [11]
Как правило, скорости комплексообразования достаточно велики и равновесие устанавливается в микросекундном или миллисекунд-ном диапазоне. На рис. 97 приведены статистические данные по распределению известных в литературе констант скоростей образования комплексов. Бимолекулярные стадии реакций с константами скоростей порядка 1010М - 1-с 1 попадают в разряд реакций, скорость которых контролируется диффузией реагентов. Для этих реакций простое столкновение реагентов приводит к образованию продукта, а само взаимодействие протекает существенно быстрее. Примером такого рода процессов могут быть реакции переноса протона, протекающие с участием относительно сильных кислот и оснований. [13]
Изучению кинетики реакций комплексообразования с ионами этих металлов посвящено много работ. Обычно реакции изучаются в условиях, допускающих обратимые процессы, так что в них можно получить и константы скорости образования комплекса, и константы обратного ( сольволитического) процесса. При этом используются самые разнообразные методы: микроволнового и ультразвукового поглощений, уширение линий спектра ЯМР, температурного скачка, остановленного потока и в редких случаях классические методы, используемые для изучения медленных реакций. В своей самой простой форме образование комплекса характеризуется двумя процессами релаксации. Вторая ступенька более медленная, скорость ее почти не зависит от природы и концентрации лиганда, но чрезвычайно чувствительна к природе иона металла и растворителя. [14]
Температура реакции также может влиять на порядок реакции. Принято, что константа скорости превращения ( или десорбции) кислородного комплекса на поверхности имеет более высокую энергию активации, чем константа скорости образования комплекса. Поэтому реакция нулевого порядка при низких температурах и данном давлении может стать реакцией первого порядка при том же давлении и достаточно высокой температуре. [15]
Страницы: 1