Константа - скорость - разложение
Cтраница 3
Оказалось, что константа скорости разложения падает в ряду л-нитрофенол п-грег-бутилфенолп-хлорфенол фенол п-крезол. [31]
Значение &2 - константы скорости разложения первичного комплекса на пероксидазу и перекись - не может быть получено прямыми измерениями. Измерения константы равновесия для диссоциации первичного и вторичного комплексов с гидроперекисью метила дали величины 3 2 10 - 6 М и 3 10 М, из которых при учете известных констант скорости процесса образования была оценена k2, оказавшаяся равной 2 2 сек. [32]
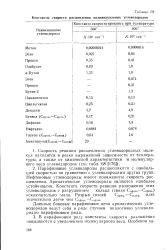 |
Константы скорости расщепления индивидуальных углеводородов. [33] |
В парафиновом ряду константы скорости разложения повышаются с увеличением молекулярного веса. [34]
Из температурного коэффициента константы скорости разложения перекиси трет. Как видно из этих значений, их различие не превосходит погрешности в определении этих величин. [35]
Из сравнения значений констант скорости разложения перекиси триметилкремнпя и трет. С скорости их превращения мало различаются. Все же перекись триметилкремния при этой температуре разлагается в два раза медленнее, чем перекись трет, бутила. [36]
Нами измерены 7 и константы скорости разложения kp при высокотемпературном пиролизе полидиалкилбутадиенфосфонатов. [37]
В табл. 1 приведены константы скоростей разложения пропана при переменных значениях температур и времени контакта, полученные различными авторами, а также рассчитанные нами графическим методом [4] по экспериментальным литературным данным. [38]
Обнаружено [1], что константа скорости разложения этана как реакции первого порядка снижается с повышением степени превращения. При выводе предложенного выше уравнения ( 12) не были учтены экспериментальные данные [25], охватывающие значения k от 7 9 - 10 - 4 до 0 036 сек 1, так как они завышены; корреляция [25] дает примерно в 3 раза большие значения. Кремер и Хаппель собрали данные, включающие значения k от 0 15 до 400 сек 1, которые, хотя и обнаруживают значительный разброс, указывают на большую точность уравнения Марека и Мак-Клюра [25] при значениях / г порядка 0 002 сек 1 и выше. Значения k в области выше - ЮО-200 се / с 1 оказываются значительно меньшими, чем вычисленные по этому уравнению, что отражает трудности измерений при весьма малой продолжительности контакта. [39]
Это следует из равнения констант скорости разложения под влиянием ионов иода. [40]
Используемые нами данные по константам скорости разложения этана, этилена и ацетилена ( прямые 5, б и 8 на рис. 3) также получены путем сопоставления экспериментальных результатов [11] с данными других авторов. Следует указать, что константы скоростей реакций для области высоких температур получены в [11, 16] при довольно высоких степенях разложения исходного вещества. Однако это не мешает использовать их в наших расчетах, рассматривая их как константы соответствующих брутто-реакций. Именно такими брутто-реакциями, а не элементарными актами, следует, по-видимому, считать стадии, через которые проходит разложение метана согласно гипотетическому механизму Касселя. [41]
Как видно из таблицы, константы скорости разложения метана, разбавленного водородом, убывают с увеличением U / vcnt, однако превышают константу скорости разложения неразбавленного метана. [42]
Как видно из таблицы, константы скорости разложения метана, разбавленного водородом, убывают с увеличением U / vcut, однако превышают константу скорости разложения неразбавленного метана. [43]
Как уже указывалось выше, константа скорости разложения гидропероксида зависит от условий его получения, возрастая с давлением кислорода, при котором она была получена. Это можно объяснить цепным распадом гидропероксидных групп, расположенных в непосредственной близости друг от друга, скорость которого выше скоростей распада изолированных групп ООН. [44]
Согласно данным табл. 38, константа скорости разложения бромистого фенилбензилметилаллиламмония уменьшается в полтора раза при увеличении давления с атмосферного до 3000 атм. Скорость обратной бимолекулярной реакции при этом возрастает в пять раз. На основе же вычисления, учитывающего влияние давления на прямую ( мономолекулярную) реакцию и на константу равновесия, скорость обратной реакции должна возрасти в шесть с половиной раз. [45]
Страницы: 1 2 3 4 5