Константа - скорость - реакция - озон
Cтраница 1
Константы скорости реакции озона с эластомерами, нанесенными на мелкозернистый силикагель с целью исключения диффузионных ограничений при температуре, 20 С, имеют следующие значения. [1]
Для определения констант скорости реакции озона с соединениями, содержащими элементоорганические кратные связи, была использована описанная выше методика. [2]
Большая разница в константах скоростей реакции озона с СС - и другими кратными связями может быть объяснена, исходя из изменения электроотрицательности системы при замене углерода на гетероатом или при образовании тройной связи. Выше было показано, что введение электроотрицательных заместителей сильно замедляет реакцию озона с СС-связью. Как следует из данных табл. 3.6, константа скорости уменьшается на пять порядков при переходе от алкильных заместителей к нитрогруппе. [3]
В табл. 6.8 приведены значения констант скорости реакции озона с парафиновыми углеводородами различного строения г линейными, разветвленными, циклическими и алкилароматиче-скими. [4]
Показано, что для исследованных соединений чем выше константы скорости реакции озона с антиозонантами, тем выше эффективность их защитного действия. [5]
 |
Связь между энергией сопряжения Д - Ес и fc3 t. [6] |
ПФАЦ и близких мономерных аналогов показывает, что константа скорости реакции озона с ПФАЦ приблизительно на два порядка меньше, чем у стирола или стильбена. Это уменьшение константы нельзя объяснить индукционными эффектами заместителей, которые в данном случае малы ( см. стирол и стильбен, стр. В то же время сопряжение с соседними СС-связями очень существенно влияет на A: 3.i ( табл. 4.15), которая изменяется на восемь порядков при переходе от несопряженной СС-связи к СС-связи с максимальным сопряжением. [7]
Из линейной зависимости k от [ / - BuOOOBu - / ] 0 / 2 рассчитано произведение констант скоростей реакций озона с алкоксильным и перок-сильным радикалами и оценена величина &3 - 1.7 107 л / моль с при - 23 С. [8]
На примере дивинилбензола нетрудно проследить изменение константы скорости после присоединения молекулы озона и показать, как оно согласуется с общими принципами теории. Константа скорости реакции озона с первой СС-связью исходного дивинил-бензола должна быть меньше, чем у стирола, за счет сопряжения связей ( подробнее см. раздел 5.1), что и наблюдается на опыте. При атаке озоном первой связи сопряжение нарушается и, казалось, следующая стадия реакции должна протекать со скоростью, близкой к стиролу ( 3 - Ю5 л / молъ-сек), однако продукты присоединения озона - озониды - оказывают заметное индуктивное влияние на реакцию, в результате чего вторая стадия протекает значительно медленнее, чем первая. [9]
Бимолекулярный характер реакции подтверждается соответствием опытных данных и функциональных зависимостей, вытекающих из бимолекулярной модели. В табл. 3.11 приведены значения констант скорости реакции озона с полимерными соединениями и их низкомолекулярными аналогами. [10]
Это заставляет осторожно оценивать возможности использования потенциалов ионизации для установления каких-либо количественных зависимостей и использовать их только для качественных сопоставлений. Сравнение данных табл. 9.12 с 9.6 и 9.9 показывает, что изменение в константах скорости реакции озона с амином происходит симбатно изменению потенциала ионизации. [11]
Предварительными опытами было установлено, что все исследуемые соединения в условиях эксперимента с сернистым газом не реагировали и при озонировании не выделяли летучих продуктов, поглощающих при длине волны 290 им. Измеряя депрессию оптической плотности газового потока на выходе из реактора и зная константу скорости реакции озона с ТБТМ iv, можно вычислить константы взаимодействия озона с исследуемыми соединениями. [12]
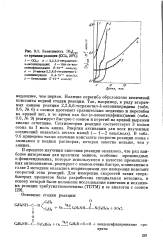 |
Зависимость газ от времени реакции ( CCU, 20 С 1 - ССЦ. 2 - 2 2 6 6-тетраметил - 4-оксопиперндвн. з - бис - ( п-изо-октилфенил амин ( 7 - Ю - моль / л. [13] |
Наличие перегиба обусловлено величиной константы первой стадии реакции. Так, например, в ряду вторичных аминов реакция 2 2 6 6-тетраметил - 4-оксопиперидина ( табл. 9.6, № 6) с озоном протекает сравнительно медленно и перегибов на кривой нет, в то время как ( шс - ( гс-изооктилфенил) амин ( табл. 9.6, № 9) реагирует быстрее с озоном и перегиб на кривой выражен вполне отчетливо. Стехиометрия реакции соответствует 3 молям озона на 1 моль амина. В табл. 9.6 приведено также значение константы скорости реакции озона с аммиаком в водных растворах, которая заметно меньше, чем у аминов. [14]
Реакция озона с двойной СС связью известна с 1855 г., когда К. Шенбейн впервые проозонировал этилен. Реакция озона с двойной связью олефина является одной из самых быстрых реакций. Ее скорость, как правило, лимитируется только скоростью подвода реагентов в зону реакции. Константа скорости реакции озона с олефина-ми в растворе составляет ( 0 4 - г10) - 105 л / моль-с, энергия активации ( 2 09 - 5 - 4 36) КДж / моль, что обусловливает слабое влияние температуры на скорость реакции, зависящей главным образом от строения исходного олефина. Увеличение числа алкильных заместителей у атома углерода при двойной связи и перемещение связи ОС в глубь молекулы приводит к заметному увеличению скорости реакции. [15]
Страницы: 1