Константа - скорость - реакция - второе - порядок
Cтраница 2
 |
Исходные данные и результаты расчета насадочного абсорбера N3 Щекинского ПО Азот. [16] |
Оценка константы скорости реакции второго порядка (6.22) дает величину более 1010 м3 / ( кмоль-ч), что подтверждает механизм реакции, основанный на переносе протона. [17]
Размерность константы скорости реакции второго порядка равна, как видно из уравнения, л / моль сек или л / моль - мин. [18]
Размерность константы скорости реакции второго порядка т 1 с -, поэтому в отличие от константы скорости реакции первого порядка численное значение k будет зависеть от того, в каких единицах выражены - тис. [19]
Размерность константы скорости реакции второго порядка т - с 1, поэтому в отличие от константы скорости реакции первого порядка числовое значение k будет зависеть от того, в каких единицах выражены тис. [20]
Размерность константы скорости реакции второго порядка k2 зависит от единиц, в которых выражена концентрация. Обычно концентрацию выражают в моль / л, а время - в секундах. [21]
Получена из константы скорости реакции второго порядка. Получена из константы скорости реакции первого порядка. [22]
Какой-либо зависимости константы скорости реакции второго порядка от диэлектрических свойств среды не наблюдается. [23]
Множитель k является константой скорости реакции второго порядка. Размерность константы л - моль-1 - величина, обратная концентрации, деленная на секунду. [24]
Множитель k является константой скорости реакции второго порядка. [25]
Отсюда видно, что константа скорости реакции второго порядка зависит от объема системы. Из уравнения также следует, что достаточно определить количество прореагировавшего вещества х через известное время t, чтобы вычислить константу скорости. [26]
В табл. 3.34 приведены константы скоростей реакций второго порядка для ряда нуклеофильных реагентов или оснований. С увеличением основности по отношению к протону константа скорости / Су возрастает. Такой результат вполне понятен для жесткой кислоты, какой является соединение Si ( acac) J. Для N2H4, NH2OH и 02Н - обнаружена более высокая реакционная способность, чем предполагалось по их основности. Однако это общий результат для нуклео-филов, имеющих атом с одной ( или более) неподеленной парой электронов, находящийся в сс-положении к нуклеофильному атому. Эта повышенная реакционная способность названа - эффектом ( см. стр. [27]
В этой области концентраций воды константа скорости реакции второго порядка почти не зависит от процентного содержания воды в реакционной среде. Таким образом, вода, вносимая в анализируемый раствор вместе со смесью аминов, почти не меняет константы скорости. Процентное содержание воды остается практически неизменным. [28]
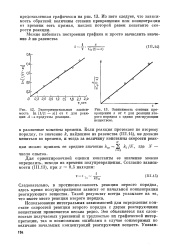 |
Экспериментальная зависимость In [ 1 / ( 1 - х ] от т для реакции А - продукты реакции.| Зависимость степени превращения х от т для реакции второго порядка с одним реагирующим веществом. [29] |
Использование интегральных зависимостей для определения констант скоростей реакции второго порядка с двумя реагирующими веществами применяется весьма редко. Это объясняется как сложностью получаемых уравнений и трудностью их графической интерпретации, так и возможными ошибками в случае соизмеримых по величине начальных концентраций реагирующих веществ. [30]
Страницы: 1 2 3 4