Константа - скорость - первая реакция
Cтраница 2
Мы уже отмечали, что дифференциальное уравнение скорости реакции для первой ступени, с помощью которого была определена константа скорости первой реакции, решено путем замены концентраций х относительно у на базе материального баланса стехиомет-рических уравнений всех ступеней на молекулярном уровне. Для данного случая в основу, например, была положена одна базисная молекула, выраженная в текущих концентрациях вида г / о - У - Затем при составлении материального баланса по каждой ступени рассматривалось преобразование этой молекулы. Проведенный таким образом материальный баланс позволяет утверждать, что баланс стехиометрических уравнений проведен на молекулярном уровне. Ведь при составлении материального баланса по любой ступени в основу рассмотрения положена все та же молекула, которая была взята для первой ступени. Только на каждой последующей уже исследуется некоторая новая молекула, полученная от первоначальной. [16]
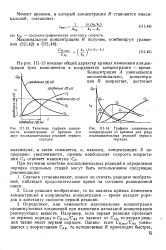 |
Типичные графики зависимости концентрации от времени для двух последовательных реакций первого порядка.| Графики зависимости. [17] |
Если реакция необратимая, то из анализа кривых изменения концентраций в координатах концентрация - время находят порядок и константу скорости первой реакции. [18]
Величина для Н Оа вычислена по данным цепной реакции Н2 02 - Величина для 0 ОН вычислена по значению константы скорости первой реакции и константы равновесия. По-видимому, энергии активации слишком низки. [19]
АГХ 71Х - 423 ( здесь Т - абсолютная температура); В - константа, зависящая от скорости газовой смеси, В 70; ki - константа скорости первой реакции; Л2 - константа скорости второй реакции. [20]
S - субстрат, Е - S - фермент-субстратный комплекс, Р - продукт, k i - константа скорости первой реакции в прямом направлении, k - - константа скорости первой реакции в обратном направлении, kz - константа скорости второй реакции, которая считается необратимой. [21]
АГ Т - 423; ДТХ Гх - 423 ( здесь Т - абсолютная температура); В - константа, зависящая от скорости газовой смеси, В 70; ki - константа скорости первой реакции; / с2 - константа скорости второй реакции. [22]
Если же константа скорости первой реакции намного превышает константу скорости второй ( k k2), то общая скорость превращения А в С определяется скоростью более медленной второй реакции. Поэтому вторую реакцию называют лимитирующей или лимитирующим звеном. Очевидно, при & 1С &2 лимитирующей будет первая реакция. [23]
 |
Зависимость радиозащитного действия фенолов от их структуры ( мыши линии Balb, 659 р. [24] |
Величина 9 является критерием активности фенольного препарата. Она пропорциональна константе скорости второй реакции ( & g), а следовательно, отношению константы скорости первой реакции ( k7) к относительной антиокислительной эффективности ( е) и может быть вычислена на основании экспериментов на манометрической и хемилюминесцентной моделях. [25]
Приведенные значения констант скоростей реакций на молекулярном уровне позволяют сделать такой вывод. Значения констант второй, третьей и четвертой ступеней отличаются друг от друга незначительно. Разница между константой скорости первой реакции и остальными довольно большая. Реакционная способность молекулы после первой реакции сильно уменьшается. [26]
Однако следует заметить, что подобное сравнение имеет лишь относительное значение, потому что отношения выходов орто - и пара-продуктов могут изменяться в зависимости от температуры; кроме того, они зависят от природы растворителя и катализатора. В общем случае для образования орго-изомеров благоприятна более высокая температура. Это явление означает, что энергия активации замещения в орго-положении больше, чем энергия активации замещения в пара-положении ( стр. Иначе говоря, константа скорости первой реакции возрастает с температурой быстрее, чем константа скорости второй реакции. [27]
II, § 1), для решения первого уравнения системы дифференциальных уравнений скоростей реакций вида dy / dr - k xy необходимо к заменить через у с помощью материального баланса стехиометрических уравнений на молекулярном уровне. Критерием точности определения этих величин служила оценка разброса значений этих параметров при неизменном технологическом режиме на всем временном отрезке. Чтобы объяснить такое положение, необходимо проанализировать и сравнить методы, с помощью которых определялись константы скорости первой реакции и относительные константы. Дифференциальные уравнения скоростей реакций, составленные для второй и последующих ступеней, кроме последней ( 2), рассматривают преобразование некоторого сообщества молекул. Ведь первый член первой части указанных уравнений учитывает скорость образования исследуемого вещества, а второй - скорость его расходования в какой-то общий для данного вещества момент времени. Но одна и та же молекула базисного компонента не может в один и тот же момент участвовать в образовании и расходовании одного и того же вещества. Под базисной молекулой мы будем понимать молекулу одного из начальных веществ, преобразование которой приводит к получению ряда новых веществ. [28]
Страницы: 1 2