Константа - скорость - прямая реакция
Cтраница 3
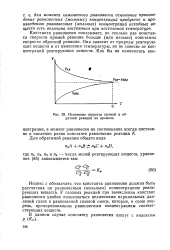 |
Изменение скорости прямой и обратной реакций во времени. [31] |
Константа равновесия показывает, во сколько раз константа скорости прямой реакции больше ( или меньше) ко станты скорости обратной реакции. Она зависит от природы реагирующих веществ и от изменения температуры, но не зависит от концентраций реагирующих веществ. [32]
Константа равновесия показывает, во сколько раз константа скорости прямой реакции больше ( или меньше) константы скорости обратной реакции. Она зависит от природы реагирующих веществ и от изменения температуры, но не зависит от концентрации реагирующих веществ. Как бы ни изменялись концентрации, в момент равновесия их соотношение всегда постоянно и численно равно константе равновесия реакции К. [33]
За меру реакционной способности [47] принимается величина константы скорости прямой реакции. [34]
Малая величина константы равновесия указывает на то, что константа скорости прямой реакции меньше константы скорости обратной реакции; равновесие в данном случае устанавливается при больших концентрациях исходных веществ и при малых концентрациях продуктов реакции. Большая величина константы равновесия говорит, напротив, о том, что равновесие устанавливается при больших концентрациях продуктов реакции и при малых концентрациях взятых веществ. [35]
Уравнение (1.30) означает, что, зная численное значение константы скорости прямой реакции и значение константы равновесия при данной температуре, можно рассчитать величину константы скорости обратной реакции. Уравнения (1.31) и (1.33) показывают, что, имея уравнение кинетики прямой реакции, полученное на опыте, и выражение для константы равновесия, задаваемое законом действующих масс, можно из1 них получить кинетическое уравнение для обратной реакции. [36]
В момент равновесия произведение действующих масс исходных веществ на константу скорости прямой реакции равно произведению действующих масс образующихся веществ на константу скорости обратной реакции. [37]
Таким образом, любое изменение, вызываемое катализатором в константе скорости прямой реакции, сопровождается соответствующим изменением в константе скорости обратной реакции. [38]
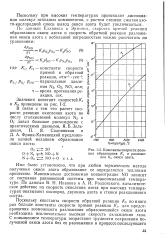 |
Константы скорости реакции образования А и разложения К. 2 окиси азота. [39] |
Поскольку константа скорости обратной реакции / С2 во много раз больше константы скорости прямой реакции / Сь для предотвращения возможности разложения образовавшейся окиси азота необходима исключительно высокая скорость охлаждения газа. [40]
Третий случай соответствует условиям первого случая, но предполагается, что константа скорости прямой реакции слабо зависит от температуры. Четвертый случай соответствует условиям, когда обе константы скорости реакций слабо зависят от температуры, с достаточной степенью точности их можно считать постоянными при небольших отклонениях температуры от номинальной величины. Наконец, пятый случай соответствует условиям первого случая, но предполагается, что возмущение по каналу потока вещества А достаточно мало ( АСЛ С А), так что можно считать концентрацию вещества А неизменной величиной и не раскрывать значение СА из первого уравнения системы. С математической точки зрения вывод уравнения для пятого случая не является строгим, но это уравнение более простое, что позволяет относительно легко оценить ряд существенных особенностей изучаемого процесса. [41]
Следовательно, чем больше удельная поверхность, тем меньше должна быть константа скорости прямой реакции при данной концентрации ионов А ( концентрации кислоты НА и ионов водорода) для того, чтобы процесс протекал в кинетическом режиме. [42]
Экзотермические обратимые реакции интенсифицируются при повышении температуры только за счет увеличения константы скорости прямой реакции. Происходит это вследствие того, что скорость обратной эндотермической реакции с повышением температуры возрастает, начиная с некоторого предела быстрее, чем прямой. В результате действительный выход продукта х повышается с ростом температуры лишь до некоторого предела ( максимума), соответствующего оптимальной температуре. При повышении температуры сверх оптимальной и действительный, и равновесный выходы падают. [43]
Следовательно, для определения скорости окисления окиси азота необходимо знать значение константы скорости прямой реакции и значение константы равновесия реакции диссоциации двуокиси азота. [44]
Закон действия масс формулируется так: в момент равновесия произведение действующих масс исходных веществ на константу скорости прямой реакции равно произведению действующих масс образующихся веществ на константу скорости обратной реакции. [45]
Страницы: 1 2 3 4 5