Константа - устойчивость - комплекс - металл
Cтраница 2
Наиболее существенным доказательством схемы (4.39) - 4.4 1) и уравнения (4.42) является найденная на этой основе константа устойчивости комплекса металла с высшей степенью окисления с субстратом-окислителем, которая оказалась близкой к соответствующей константе устойчивости, полученной другими ( неэлектрохимическими) методами. [16]
Если логарифмы константы устойчивости комплекса металла с индикатором, отрицательный логарифм начальной концентрации титруемого металла и логарифм константы устойчивости комплекса металла с комплексоном III отличаются примерно-на единицу, то ошибка титрования будет незначительной. Если же указанные параметры отличаются друг от друга в меньшей степени, то ошибка титрования может значительно возрасти. Этим условием определяется наименьшая; концентрация титруемого металла. [17]
Если логарифмы константы устойчивости комплекса металла с индикатором, отрицательный логарифм начальной концентрации титруемого металла и логарифм константы устойчивости комплекса металла с комплексоном III отличаются примерно на единицу, то ошибка титрования будет незначительной. Если же указанные параметры отличаются друг от друга в меньшей степени, то ошибка титрования может значительно возрасти. Этим условием определяется наименьшая концентрация титруемого металла. [18]
Особенно часто обсуждаются зависимости констант устойчивости комплексов металлов от констант диссоциации или констант протоиирования органических реагентов. В пределах одного класса реагентов, кислотно-основные свойства которых изменяются за счет введения электроноактивиых заместителей в молекулу, наблюдается линейная зависимость между логарифмическими значениями констант устойчивости и константами Гаммета заместителей, характеризующими их электроиоактивиые свойства. [19]
Для определения равновесных концентраций лиганда, свободных ионов металла или какого-либо комплекса используют потенциометрический и полярографический методы, метод измерения давления пара ( для таких лигандов, как NH3, СО -), метод, основанный на изучении распределения ионов металла, лиганда или комплекса между двумя несмешивающимися растворителями, и другие методы. Основные принципы потенциометрического и полярографического методов определения состава и констант устойчивости комплексов металлов излагаются в гл. [20]
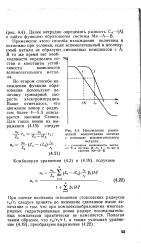 |
Нахождение равновесной концентрации лиганда с помощью вспомогательного металла. [21] |
Применение этого способа нахождения величины п возможно при условии, если вспомогательный и исследуемый металл не образуют смешанных комплексов с А. В то же время нет необходимости определять со - став и константы устойчивости комплексов вспомогательного металла. [22]
Качественные теории комплексообразования позволяют ориентироваться в большом экспериментальном материале по химии комплексообразования. Как и отмечалось выше, количественных теоретически обоснованных подходов, которые позволяли бы априори оценивать константы устойчивости комплексов металлов, пока не существует. Задача создания таких методов очень сложна и далека от своего решения. В то же время накоплен большой массив данных по константам равновесий реакций комплексообразования. [23]
Эриохромовый черный Т образует комплексы красного цвета более чем с двадцатью ионами металлов, но только некоторые из этих комплексов обладают устойчивостью, пригодной для определения конечной точки. Индикатор для титрования раствором ЭДТА должен образовывать с ионом металла комплекс с константой устойчивости, в 10 раз меньшей, чем константа устойчивости комплекса металла с ЭДТА, иначе титрование закончится преждевременно. Наоборот, если различие в величинах констант устойчивости слишком мало, как, например, в случае иона кальция, конец титрования будет фиксироваться слишком поздно. Пригодность данного индикатора для титрования раствором ЭДТА можно определить по изменению рМ вблизи точки эквивалентности, если константа устойчивости комплекса иона металла с индикатором известна. [24]
Индикаторная ошибка титрования вычисляется аналогично ошибке в осадительном титровании. Для этого нужно знать концентрацию взятого для титрования [ Me ], [ Me ] в точке эквивалентности, которая вычисляется на основании константы устойчивости комплекса с ЭДТА при данном рН и [ Me ] в момент, когда индикатор меняет окраску. Эта величина вычисляется с использованием константы устойчивости комплекса металла с индикатором. [25]
Все ферменты, содержащие металлы, подвергаются отравлению различными комплексообразующими реагентами. По картиле отравления судят обычно о том, какой именно металл содержится в белке. Следует помнить, однако, что константа устойчивости комплекса металла со специфическим реагентом, измеренная в растворе ионов металла, не дает количественной характеристики связывания металла, входящего в состав фермента с тем же реагентом. [26]
Вместе с тем для введенных извне комплексонов в первую очередь доступна та часть металла, которая циркулирует в ионном или молекулярно-дисперсном состоянии. Эффективность комплексонов зависит от прочности или устойчивости образованных с данным металлом соединений, но она изменяется ( симбат-но) константе вытеснения ионов кальция из его комплексов с тем же комплексообразователем. Если константа устойчивости комплекса металла ниже таковой для кальция, то введение комплексообразователя малоэффективно. Поэтому соответственно колеблется и эффективность ЭДТУ как средства ускорения элиминации металлов. [27]
Склонность ионов металлов к преимущественному взаимодействию с комплексообразующими группировками определенных типов была рассмотрена в гл. Так, многозарядные катионы образуют наиболее прочные связи с анионами, имеющими заряд - 2 и более высокий, и с увеличением атомного номера связи с серой становятся более прочными, чем с кислородом. Эта реакция неизбирательна, но ее можно сделать более избирательной, выполняя определение в растворах минеральной кислоты, где могут образоваться устойчивые трис-комплексы только этих трех ионов. Использование такого свойства металлов важно для улучшения избирательности реагентов, особенно за счет применения реакций маскирования ( например, Fe ( III) органическими окси-кислотами или переходных элементов цианид-ионом), основанных на разнице в константах устойчивости комплексов металлов с комплексообразующими веществами различных типов. [28]
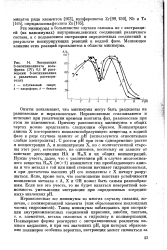 |
Экстракция 8-оксихинолината вольфрама ( IV 0 1 М растворами 8-оксихинолина в различных растворителях. [29] |
Опыты показывают, что минимумы могут быть разделены на равновесные и неравновесные. Неравновесные сглаживаются и исчезают при увеличении времени контакта фаз, равновесные при этом не изменяются. С ростом рН при этом одновременно растет и концентрация А, и концентрация X, но с количественной стороны этот рост, естественно, не одинаков, поскольку он зависит от констант диссоциации НА и НтХ и их общих концентраций. Нужно учесть, далее, что с увеличением рН в случае многоосновного вещества НтХ ( т1) изменяется тип преобладающего аниона и что металл в той или иной степени начинает гидролизоватъся, и при достаточно высоких рН его комплексы с X начнут разрушаться. Ясно, кроме того, что соотношение констант устойчивости комплексов металла с А, X и ОН может быть самым разнообразным. [30]
Страницы: 1 2 3