Энтропийная константа
Cтраница 2
Очевидно, что последний член приведенного выражения представляет собой не что иное, как составляющую энтропийной константы. [16]
Вследствие температурного изменения g мне представляется нерациональным включать, как это часто делают, электронную составляющую энтропии в величину энтропийной константы. [17]
Изложенный метод эмпирического вычисления химических постоянных и энтропийных констант и совпадение результатов такого вычисления с квантовыми формулами доказывают справедливость понимания энтропийной константы как энтропии газа при Т 1 К и р 1 атм по отношению к кристаллу того же вещества при 0 К. [18]
Не приходится говорить об энтропийной константе газа как о величине абсолютно неизменной; когда мы берем трехатомный газ и пишем для него энтропийную константу, которая не равна энтропийной константе одноатомного газа, то это справедливо до тех пор, пока газ ведет себя как трехатомный; при достаточно же низких температурах в уравнениях того же трехатомного газа фигурирует уже энтропийная константа одноатомного газа. [19]
Здесь ha - опять наивероятнейший размер клубка, h - размер его переменный в данных условиях, k - постоянная Больцмана и С - энтропийная константа. [20]
Истинную химическую константу / можно найти по уравнению ( IV, 64): j ( S0 - Ср о) / Я, где S0 - энтропийная константа [ см. уравнение ( III 20а), которая может быть вычислена для газов с несложными молекулами методами статистической физики. [21]
Истинную химическую константу / можно найти по уравнению ( IV, 64): / ( S0 - Ср с) / Я, где S0 - энтропийная константа [ см. уравнение ( III, 20а), которая может быть вычислена для газов с несложными молекулами методами статистической физики. [22]
Большое внимание в пятой главе уделено опровержению идеи о тепловой смерти Вселенной; существенными также представляются замечания о неточности дебаевской формулы теплоемкости и указание на зональное изменение энтропийных констант. [23]
Не приходится говорить об энтропийной константе газа как о величине абсолютно неизменной; когда мы берем трехатомный газ и пишем для него энтропийную константу, которая не равна энтропийной константе одноатомного газа, то это справедливо до тех пор, пока газ ведет себя как трехатомный; при достаточно же низких температурах в уравнениях того же трехатомного газа фигурирует уже энтропийная константа одноатомного газа. [24]
В шестой главе следует отметить молекулярное пояснение содержания закона Нернста и возражение против льюисовского его расширения; несколько измененный вывод следствий из этого закона; вывод уравнения Нернста для расчета энтропийных констант, принцип термодинамической допустимости, толкование химических постоянных и вывод формулы Тет-родэ. [25]
Что же касается двух других членов ( которые легко объединить в один, если последнему члену приписать равный единице множитель 1пе), то очевидно, что в сумме они представляют собой вращательную составляющую энтропийной константы. [26]
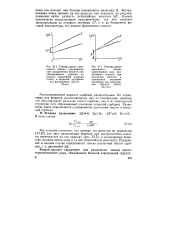
Эти условия означают, что прямые, построенные по уравнению (XI.20) для двух разделяемых веществ, при экстраполяции должны пересекаться на оси ординат ( рис. XI.5), а разделяемые вещества должны иметь одну и ту же энтропийную константу. [28]
Не приходится говорить об энтропийной константе газа как о величине абсолютно неизменной; когда мы берем трехатомный газ и пишем для него энтропийную константу, которая не равна энтропийной константе одноатомного газа, то это справедливо до тех пор, пока газ ведет себя как трехатомный; при достаточно же низких температурах в уравнениях того же трехатомного газа фигурирует уже энтропийная константа одноатомного газа. [29]
Энтропийная константа В - Л) / 2ЗОЗД и связанная с дифференциальным мольным изменением внутренней энергии константа А - AUl / 2 3Q3R приняты в этом уравнении не зависящими от температуры. [30]
Страницы: 1 2 3