Приведенная константа - скорость
Cтраница 2
Анализ результатов показывает, что получено достаточно хорошее совпадение значений приведенных констант скоростей для всех четырех опытов. Поэтому считали, что средние значения констант можно достаточно надежно использовать для составления математического описания данного химического процесса в рассматриваемой локальной области при 15 С. [16]
Они оказались равными соответственно 100, 18 к 300 минутам и были сим-батны ранее приведенным константам скоростей зтих дике. [17]
См - концентрация мономера в жидкой фазе, окружающей частицу; Р - производительность катализатора; k - приведенная константа скорости полимеризации; - константа равновесия между мономером в растворе и в полимере. [18]
Из сравнения (4.6) и (3.6) нетрудно усмотреть, что при соответствующем выборе эффективного числа столкновений Z при Ъ s выражения для приведенных констант скоростей теорий Касселя и Слейтера совпадают, если число колебательных степеней свободы активированной молекулы в теории Слейтера принять в два раза большим числа степеней свободы активированной молекулы в теории Касселя г. Физическая причина различия этих теорий ясна. Слабая ангармоничность, неявно учитываемая в теории Касселя, существенно увеличивает фазовый объем активной молекулы, приводя в то же время к уменьшению различий в эффективности различных степеней свободы. Это означает, в частности, что если для интерпретации экспериментальных данных используется формула Касселя с эффективным числом осцилляторов, меньшим истинного числа колебательных степеней свободы, то при этом неявно предполагается, что взаимодействие координаты реакции с неэффективными степенями свободы меньше, чем взаимодействие между нормальными координатами в результате ангармоничности. Отсюда, в частности, можно усмотреть те трудности, с которыми приходится встречаться при попытке разделить активные и неактивные степени свободы. [19]
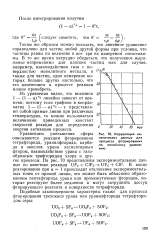 |
Корреляция кинетических данных для процесса фторирования по линейному уравнению. [20] |
Из уравнения видно, что величина 1 - ( 1 - а) 1 / з линейно зависит от времени; поэтому если графики в координатах 1 - ( 1 - a) 1 / s - т представляют собой прямые линии при различных температурах, то можно пользоваться величинами приведенных констант скоростей реакции для определения энергии активации процесса. [21]
В табл. 142 показано, каким образом в реакциях бимолекулярного элиминирования у вторичных и третичных алкилгалогенидов сочетаются эффекты, влияющие на скорость реакции и ориентацию. В данном случае ранее приведенные константы скоростей второго порядка, представляющие собой скорости элиминирования олефина из различных ветвей алкильных групп, противопоставлены другим группам, находящимся в разных концах молекулы. Приведенные же величины относятся к радикалам в а - и р-положениях образующейся двойной связи. [22]
Поскольку опыты проводились при различных темпертурах, то для каждой скорости потока дается приведенная константа скорости RW, найденная по кривой Аррениуса. [23]
Хотя для выполнения функции постороннего электролита были бы достаточны и меньшие концентрации, была выбрана ионная сила, равная 1, в основном для подавления диффузной части двойного слоя. Таким образом, все приведенные константы скорости и коэффициенты переноса заряда следует рассматривать как кажущиеся величины. [24]
Страницы: 1 2