Контакт - железо
Cтраница 2
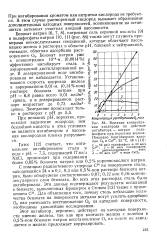 |
Влияние концентрации кислорода на действие ингибитора - натрия полифосфата при коррозии железа. Показано благотворное влияние О2 и Са2 25 С, 48 ч. [16] |
Этот ингибитор, вероятно, действует на катодные поверхности именно железа, так как при контакте железа с золотом в 0 5 % - ном бензоате натрия восстановление О2 на золоте не замедляется и железо продолжает корродировать. [17]
Однако, если предположить, что кривая для более благородного металла всегда расположена выше кривой менее благородного металла, то легко видеть, почему, лри избытке кислорода в жидкости, контакт железа, например, с медью, дает большей величины ток ( и отсюда большую коррозию), чем контакт со свинцом. При условии недостатка кислорода деполяризация определяется скоростью поступления кислорода к катодному металлу, и ток не зависит от природы металла, что соответствует принципу бассейна. Распределение корродирующих участков может однако зависеть от катодного металла. [18]
Использование цветных металлов и легированных сталей для изготовления аппаратуры сопряжено е большими затруднениями вследствие высокой стоимости и дефицитности этих материалов; поэтому широкое распространение получили способы, заключающиеся в покрытии обычных сталей защитными слоями, предохраняющими металл от разрушающего действия перерабатываемых в аппаратах веществ и исключающими контакт железа с реакционной средой. Такие защитные покрытия могут быть металлическими и неметаллическими. [19]
Особенно распространена атмосферная коррозия металла. Например, при контакте железа с медью, находящихся во влажном воздухе, возникает гальванический элемент, в котором анодом служит железо, а катодом - медь. [20]
Так, железо, находящееся в контакте с раствором, рН которого выше 9 - 10, практически не корродирует. Следовательно, при контакте железа с цинком растворяется цинк, а при контакте железа с оловом растворяется железо. Роль электрода гальванического элемента могут играть карбиды. Так, обычная сталь содержит зерна цементита Fe3C, на которые переходят электроны с зерен железа. [21]
Темп разрушения стальных конструкций в пристутствии загрязнителей прогрессирующе нарастает, что свидетельствует о динамическом характере физико-химических процессов, идущих при коррозии железа. Предполагается, что вначале на поверхности контакта железа с кислородом, влагой и загрязнителем также образуется гидрооксид, а затем - соль соответствующего аниона, которая далее гидролизуется, вновь приводя к гидрооксиду железа. Высвободившийся при гидролизе кислотный анион повторно оказывает корродирующее воздействие. [22]
Метод основан на том, что между обрабатываемым и полирующим металлом в определенной среде ( электролите) возникает электрохимический процесс, в результате чего образуются гальванопары. Такая пара, например, возникает при контакте железа с медью, где железо имеет потенциал - 0 44 В, а медь 0 34 В. Этим объясняется интенсивный съем металла в процессе одновременного механического и электрохимического воздействия на обрабатываемую поверхность. [23]
Мак Куллох 2 изучал местное разрушение в месте контакта железа и резины; в то время автор3 считал, что явление это аналогично вышеописанным, но оказалось, что по крайней мере в некоторых случаях коррозия в зазоре между металлом и резиной может быть объяснена присутствием серы в резине. [24]
Как видно, усиление контактной коррозии зависит в значительной степени от сезона испытаний; в осеннее время она сильнее. Наибольшая скорость коррозии при исследовании контактных пар наблюдается при контакте железа с медью, а наименьшая - при контакте олова с медью. Такая закономерность отмечена для обоих сезонов года. [25]
Изучение окисления при 590 С показывает, что скорость образования водорода при этих условиях остается низкой, что ведет к малой производительности по водороду и низкой степени разложения пара. Для получения большой производительности по водороду при использовании в качестве контакта железа требуются более высокие температуры. [26]
Защитное действие использованных силикатных стекол можно, по-видимому, связать с восстановлением окислов из стекла до металлов при наплавлении покрытий и выделением металлов на поверхности железа. Так, в более ранних работах [13-16] было обнаружено, что при контакте железа с силикатными расплавами, содержащими окислы свинца, меди, кобальта или никеля, происходит их восстановление. [27]
Так, железо, находящееся в контакте с раствором, рН которого выше 9 - 10, практически не корродирует. Следовательно, при контакте железа с цинком растворяется цинк, а при контакте железа с оловом растворяется железо. Роль электрода гальванического элемента могут играть карбиды. Так, обычная сталь содержит зерна цементита Fe3C, на которые переходят электроны с зерен железа. [28]
 |
Ржавление железа без контакта ( а и в контакте с медной ( б и цинковой ( в проволокой. [29] |
Вследствие своей рыхлости ржавчина не предохраняет железо от дальнейшего разрушения, а, наоборот, притягивая из воздуха влагу, она лишь усиливает, как бы катализирует коррозию железа. Поэтому в борьбе с коррозией железа особое значение имеют предупредительные меры: окраска масляными красками, металлические покрытия и пр. Контакт железа с более благородным металлом резко усиливает коррозию железа, контакт же его с менее благородным металлом может полностью прекратить ее: в этом случае железо предохраняется от коррозии за счет усиленного разрушения соприкасающегося с ним менее благородного металла. [30]
Страницы: 1 2 3