Контакт - металл
Cтраница 1
Контакт металла, находящегося в зазоре, с металлом, к которому имеется свободный доступ электролита, не приводит, как это наблюдалось, например на алюминии и нержавеющей стали, к заметному увеличению скорости процесса. Причины такого аномального поведения магния еще не совсем понятны. Очевидно, они обусловлены в некоторой степени подщелачиванием среды. В результате деятельности микроэлементов электролит в щели довольно быстро насыщается гидратом окиси магния. Подщелачивание для магния ведет, как известно, к облагораживанию потенциала. Поэтому металл, находящийся в зазоре, становится катодом. Разность потенциалов между металлом, находящимся в зазоре, и металлом, корродирующим в условиях свободного доступа кислорода, однако, незначительна; она не превышает нескольких милливольт. Поэтому практически такой элемент мало эффективен. [1]
Контакт металла с электролитом Полезно рассмотреть кратко контакт металла с электролитом ( фиг. [2]
Контакт металлов с массой сыпучих материалов не только изменяет характер коррозии, но и может значительно ускорять процесс коррозионного разрушения. [3]
Контакт металлов, входящих в одну и ту же группу, считается допустимым. Металлы каждой последующей группы усиливают коррозию металлов предыдущей группы. Коррозия может, однако, наблюдаться и при контакте металлов внутри группы: металлы каждой группы, как правило, подвергаются коррозии, находясь в контакте с металлами, расположенными в группе за ними. [4]
Контакт металла, находящегося в зазоре, с металлом, к которому имеется свободный доступ электролита, не приводит, как это наблюдалось, например на алюминии и нержавеющей стали, к заметному увеличению скорости процесса. Причины такого аномального поведения магния еще не совсем понятны. Очевидно, они обусловлены в некоторой степени подщелачиванием среды. В результате деятельности микроэлементов электролит в щели довольно быстро насыщается гидратом окиси магния. Подщелачивание для магния ведет, как известно, к облагораживанию потенциала. Поэтому металл, находящийся в зазоре, становится катодом. Поэтому практически такой элемент мало эффективен. [5]
Контакт металла с таким полупроводником не образует запирающего слоя и не оказывает выпрямляющего действия на переменные токи. [6]
Контакт металла с окисной пленкой создает скачок потенциала между ними. В то же время проникновение ионов 0 - через окисную пленку и их адсорбция на поверхности металла под пленкой изменяют состав и характер пограничного слоя между металлом и фазовым окислом, придавая контактному скачку потенциала барьерный характер. [7]
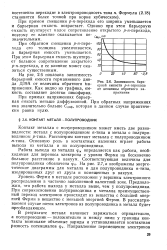 |
Зависимость барьерной емкости / 7-п-перехода от величины обратного напряжения. [8] |
Контакт металла с полупроводником может иметь две разновидности: металл с полупроводником л-типа и металл с полупроводником р-типа. Рассмотрим контакт металла с полупроводником л-типа. Основную роль в контактных явлениях играет работа выхода из металла и из полупроводника. [9]
Контакт металлов, обладающих разными электродными потенциалами, приводит к усилению коррозии. В таких случаях целесообразно между металлами устанавливать электроизолирующие прокладки. [10]
Контакт металла с поверхностью однородного кристалла обладает выпрямляющими свойствами, которые не зависят от материала электрода, но значительно ухудшаются при снижении давления окружающего воздуха. [11]
Контакт металла с поверхностью однородного кристалла обладает выпрямляющими свойствами, которые не зависят от материала электрода, но значительно ухудшаются при снижении давления окружающего воздуха. [12]
Контакт металлов, входящих в одну и ту же группу, считается допустимым. Металлы каждой последующей группы усиливают коррозию металлов предыдущей группы. Коррозия может, однако, наблюдаться и при контакте металлов внутри группы: металлы каждой группы, как правило, подвергаются коррозии, находясь в контакте с металлами, расположенными в группе за ними. [13]
 |
Схема возникновения коррозионных элементов. [14] |
Контакт металла с почвенным электролитом вызывает образование коррозионных элементов. [15]
Страницы: 1 2 3 4