Аспартаза
Cтраница 1
Аспартаза катализирует реакцию присоединения аммиака к фумаровой кислоте. Фермент в иммобилизованном состоянии сохраняет активность на исходном уровне до 2 - 2 5 недель и более. [1]
Аспартаза обнаружена в растениях и микроорганизмах, но не в организме человека. [2]
Эта реакция катализируется аспартазой - одним из первых исследованных бактериальных ферментов. [3]
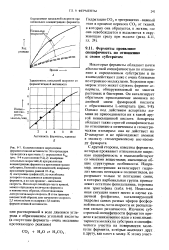
Приведенные ниже данные для аспартазы иллюстрируют преимущество, которым обладает одна форма уравнения Лайнуивера - Берка по сравнению с другой. [4]
Эта реакция, катализируемая аспартазой, тоже обратима. [5]
Реакция ( а) катализируется содержащимся в бактериях ферментом аспартазой. Однако присутствие аспартазы у высших растений сомнительно. [6]
Реакция ( а) катализируется содержащимся в бактериях ферментом аспартазой. Однако присутствие аспартазы у высших растений сомнительно. [7]
Интересно отметить, что обе аминокислоты были получены: менно в той оптической форме, в какой они встречаются в при-оде. Механизм двух последних реакций трудно описать приведении выше индексом реакций, катализируемых аспартазой. [8]
Непредельные кислоты с ненасыщенностью в а-и р-положениях образуются посредством отщепления аммиака. Эта реакция обратимая; она наблюдается у микроорганизмов и в растениях при действии фермента аспартазы на аспарагиновую кислоту. У животных она доказана для гистидина. [9]
Продукт - аргиниисукцинат - распадается на фумарат и сукцинат в результате реакции, которая катализируется аргининосукциназой ( L-аргининосукцинат - аргинин-лиазой) и которая формально сходна с реакцией, катализируемой аспартазой ( см. стр. [10]
Некоторые ферменты обладают почти абсолютной специфичностью по отношению к определенным субстратам и не взаимодействуют даже с очень близкими по строению молекулами. Хорошим примером этого может служить фермент ас-партаза, обнаруживаемый во многих растениях и бактериях. Однако под действием аспартазы аммиак не присоединяется ни к какой другой ненасыщенной кислоте. Аспартаза обладает также строгой специфичностью по отношению к оптическим и геометрическим изомерам: она не действует на D-аспартат и не присоединяет аммиак к малеату-геометрическому i / мс-изоме-ру фумарата. [12]
Таким образом, 18О, присутствующий в составе уреидогруппы, переходит в молекулу AMP. Аргининосукциназа ( рис. 14 - 4, реакция ж) катализирует элиминирование аргинина с образованием фума-рата. Фермент полностью аналогичен бактериальной аспартазе, элиминирующей аммиак из аспартата и тоже образующей фумарат. [13]
Содержимое пробирки было разделено на 31 фракцию равного объема. Фракции собирали по каплям, последовательно вытекающим через дно пробирки. Каталаза оказалась в седьмой фракции, а аспартаза - в одиннадцатой. [14]
Страницы: 1 2