Диаграмма - фазовое равновесие - система
Cтраница 1
Диаграмма фазового равновесия системы ниобий-кремний была изучена Кнэптоном [52], который использовал сплавы кремния с ниобием различного состава в форме бусин, получаемых совместным плавлением ниобия и кремния в аргонной дуговой печи. [1]
Диаграмма фазового равновесия системы сплавов Fe-Со приведена на рис. 125, а. Температура Кюри О повышается с увеличением количества кобальта и при 17 % Со пересекает границу а у-области. [2]
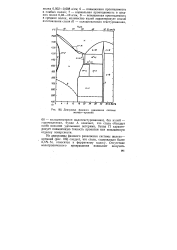 |
Диаграмма фазового равновесия системы железо-кремний. [3] |
Из диаграммы фазового равновесия системы железо - кремний ( рис. 102) следует, что сталь, содержащая более 2 5 % Si, относится к ферритному классу. [4]
Своеобразный вид диаграммы фазового равновесия системы жесткоцепной полимер - растворитель ( см. рис. 3.4), теоретически предсказанный Флори, был в дальнейшем блестяще подтвержден экспериментально. Примеры таких экспериментальных диаграмм будут приведены ниже. Здесь же следует уделить место другим соображениям Флори, имеющим принципиальное значение для всей области жесткоцепных полимеров. [5]
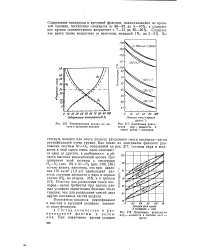 |
Распределение аргона по высоте IB аргонной колонне.| Диаграмма равновесия пар - жидкость в смеси аргон - кислород. [6] |
Как видно из диаграммы фазового равновесия системы AT-62, показанной на рис. 217, составы пара и жидкости в этой смеси очень мало отличаются один от другого, в особенности в области высоких концентраций аргона. Поэтому для разделения смеси кислород-аргон требуется при прочих равных условиях значительно большее число тарелок, чем для разделения смесей двух других составных частей воздуха. [7]
 |
Связь между кривыми охлаждения и. [8] |
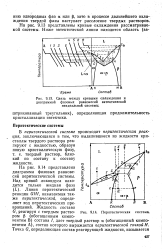
На рис. 9.14 представлена диаграмма фазовых равновесий перитектической системы. Линия перитектической реакции GHI, называемая также перитектической, определяет ход перитектических превращений. [9]
На рис. 1 - 7, б представлена диаграмма фазового равновесия системы с ограниченной растворимостью в твердом состоянии, у которой точка нонвариантного состояния расположена между температурами плавления чистых компонентов. Как и в предыдущем случае, здесь из расплава образуются два твердых раствора аир. [10]
На рис. 147, а представлена в упрощенном виде диаграмма фазового равновесия системы полимер - пластификатор. [11]
 |
Кристаллическая структура соединений Mg2BIV. [12] |
Таким образом, уже при чисто внешнем описании и сравнении диаграмм фазового равновесия систем Mg - BIV видноt что анионное замещение на более тяжелый элемент приводит к существенному изменению общего характера химического взаимодействия в системе. Следовательно, характер химической связи компонентов играет важную роль и оказывает существенное влияние на конечные результаты химического взаимодействия. [13]
 |
Диаграммы состояния системы. [14] |
Когда раствор кристаллизующегося полимера попадает в осадительную ванну и происходит диффузионный обмен растворителя на вещества, входящие в состав осадительной ванны, диаграмма фазового равновесия системы изменяется. При быстром протекании процессов кристаллизации образуется непрочная нить, содержащая сферолиты полимера. Такая нить, как правило, с трудом поддается вытягиванию с целью ориентации и очень хрупка. Если же процессы кристаллизации заторможены ( например, вследствие большого переохлаждения и относительно невысокой концентрации полимера), начинается распад полимера на аморфные фазы и система ведет себя как раствор обычного некристаллизующегося полимера. В результате происходит застудневание нити, при котором неравновесный раствор превращается в равновесную фазу и его концентрация постепенно увеличивается. Это может ускорить процессы кристаллизации ( увеличение степени пересыщения), но при быстром застудневании время достижения состояния низкой текучести невелико, и поэтому в образовавшейся нити степень кристалличности будет невысокой. [15]
Страницы: 1 2