Ассоциация - анион
Cтраница 1
Ассоциация аниона со спиртом по схеме ( 31) влияет на прочность его связи с противоионом и, следовательно, степень диссоциации и активность ионной пары, что еще более усложняет ситуацию. [1]
Помимо ассоциации аниона и катиона, направленность гомогенных реакций электронного переноса определяется также стабильностью продуктов, зависящей от распределения в их молекулах электронной плотности. [2]
Предпочтительность такого переходного состояния может быть связана с образованием ионных нар, которое требует; тесной ассоциации амид-ного аниона и катиона лития. Если литий координирован также и с эпоксидный кислородом, то, должно происходить сил - элиминирование. [3]
Предпочтительность такого переходного состояния может быть связана с образованием ионных нар, которое требует, тесной ассоциации амид-ного аниона и катиона лития. [4]
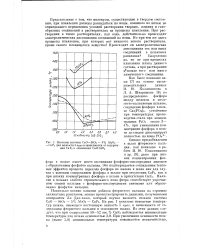 |
Изокомы системы CaO - SiC2 - 5 % AUOg - - CaFa для вязкости 5 пуаз в зависимости от содержания CaF2 и отношения CaO. Si02. [5] |
Однако при добавлении в шлак фтористого кальция, как показано в работе И. Ю. Кожевникова и др. [9], даже при низких концентрациях фосфора в шлаке имеет место ассоциация фосфорно-кислородных анионов с образованием фосфатов кальция. Это подтверждается совпадением тепловых эффектов процесса перехода фосфора из железа в шлак как для случая с высоким содержанием фосфора в шлаке при отсутствии CaF2, так и при низких концентрациях фосфора в шлаке в присутствии CaFa. Наличие в шлаках слабого отрицательного иона фтора способствует упрочнению связей кальция с фосфорно-кислородными анионами или образованию фосфатов кальция. [6]
В растворителях умеренной полярности ( 15Се40, высшие спирты, ацетон) равновесие диссоциации M Y - M Y - сдвинуто в сторону образования ионной пары. Ассоциация аниона Y - с катионом уменьшает нуклеофильную активность аниона так же, как и специфическая сольватация за счет водородной связи. Особенно прочные ионные пары образуются ионами небольшого размера, поэтому увеличение размеров катиона всегда способствует росту нуклеофильности аниона, что следует иметь в виду при выборе катализатора. [7]
Влияние координационной воды на форму анионных ас-социатов определяется прежде всего стерическими факторами. Так, в структурах гидратов невозможно образование бесконечных трехмерных ассоциаций анионов 02Х ( ОН) 2И - 2) -, поскольку для размещения комплексных катионов требуются большие полости между анионами. Существенно также, что молекулы координационной воды нередко образуют водородные мостики с ионами 0 - кислых анионов и этим ослабляют Н - связи между анионами. [8]
Кислые силикаты и их аналоги классифицированы по степени полимеризации аниона и числу протонов в его составе. Рассмотрена роль воды в структурах гидратов кислых солей и ее влияние на ассоциацию анионов. [9]
Количество электролита в ванне необходимо строго контролировать, так как при его избытке лишенные отрицательного заряда частицы красителя легко ассоциируют в крупные агрегаты, не способные непосредственно принимать участие в процессе крашения. Это приводит к снижению содержания красителя в волокне. Оптимальная концентрация электролита в красильной ванне зависит от температуры крашения, природы электролита, наличия в ванне гидрофильных органических растворителей или текстильно-вспомогательных веществ и некоторых других факторов. Повышение температуры крашения, введение в красильный раствор органических растворителей или текстильно-вспомогательных веществ противодействуют ассоциации анионов красителя; в этих случаях оптимальное значение концентрации нейтрального электролита повышается. Увеличение валентности катиона электролита позволяет снизить оптимальную концентрацию соли. [10]
Рауля указывают на то, что коллоидные частицы образуются путем ассоциации индивидуальных молекул или ионов мыла. При этом, однако, эти изменения в электропроводности и в осмотических свойствах не соответствуют друг другу по величине, и, например, значения электропроводности оказываются более высокими, чем те значения, которые можно ожидать на основании измерений осмотических свойств. Вскоре после того, как стал известен указанный основной факт различия в величине изменений электропроводности и осмотических свойств, было со всей определенностью доказано, что высокая электропроводность не связана с гидролизом мыла. Все это привело Мак-Бэна к мысли об образовании коллоидных частиц, или мицелл, в результате ассоциации длинноцепочечных анионов жирной кислоты, обладающих большим электрическим зарядом. Эта картина далее была детально разработана и развита, но и сейчас в своей основе она остается неизменной. Свойства анионных и катионных поверхностноактивных веществ, относящихся к группе соединений, называемых коллоидными электролитами, являются во многих отношениях сходными, так же как и свойства других соединений этого типа, как, например, многих красителей и аналогичных солей высокомолекулярных органических кислот или оснований, обладающих поверхностной активностью, присущей обычным молекулярнорастворимым веществам. Помимо заряженных или ионных мицелл в растворах коллоидных электролитов могут находиться мицеллы со сравнительно небольшим зарядом, а в растворах неионогенных поверхностноактивных веществ образуются только незаряженные мицеллы, вследствие чего исследование коллоидных свойств этих соединений является значительно более простым. [11]
 |
Изотерма адсорбции додецилсульфата натрия. из 0 1 М раствора NaCl при рМ 6 5 на оксиде алюминия ( удельная поверхнбсть 15 Ю3 ма / кг. [12] |
На кривой изотермы, представленной в билогарифмических координатах на рис. 4.9, более или менее четко можно установить четыре различающиеся области. При низких концентрациях равновесного раствора изотерма линейна и тангенс угла наклона прямой к оси концентраций практически равен единице. При равновесной концентрации раствора около 7 5 - Ю-5 моль / л достигается плотность покрытия поверхности анионами ПАВ примерно 3 - 1б - 9 моль / м и на изотерме адсорбции появляется резкий переход от первой области ко второй. В этом интервале концентраций удельная адсорбция значительно возрастает. На протяжении всей второй области изотерма также практически линейна. Далее достаточно четко видна третья область изотермы, которая имеет вид слабо выпуклой кривой и продолжается вплоть до достижения ККМ. Образование мицелл в растворе сопровождается трехмерной ассоциацией анионов додецилсульфата в адсорбционном слое, что приводит к новому резкому увеличению адсорбции, после чего наступает заключительная четвертая область изотермы. [13]
 |
Изотерма адсорбции додецилсульфата натрия из М раствора NaCI при рН 6 5 на оксиде алюминия ( удельная поверхность 15 - Ю3 м2 / кг. [14] |
На кривой изотермы, представленной в билогарифмических координатах на рис. 4.9, более или менее четко можно установить четыре различающиеся области. При низких концентрациях равновесного раствора изотерма линейна и тангенс угла наклона прямой к оси концентраций практически равен единице. При равновесной концентрации раствора около 7 5 - Ю-5 моль / л достигается плотность покрытия поверхности анионами ПАВ примерно 3 - Ю - - 9 моль / м и на изотерме адсорбции появляется резкий переход от первой области ко второй. В этом интервале концентраций удельная адсорбция значительно возрастает. На протяжении всей второй области изотерма также практически линейна. Далее достаточно четко видна третья область изотермы, которая имеет вид слабо выпуклой кривой и продолжается вплоть до достижения КК. Образование мицелл в растворе сопровождается трехмерной ассоциацией анионов додецилсульфата в адсорбционном слое, что приводит к новому резкому увеличению адсорбции, после чего наступает заключительная четвертая область изотермы. [15]
Страницы: 1