Диаграмма - взаимная система
Cтраница 1
Диаграммы взаимных систем в зависимости от способа выражения состава раствора могут иметь вид ( см. табл. 9.1, стр. [1]
Свойства такой диаграммы взаимной системы вполне аналогичны свойствам диаграмм простой четырехкомпонентной системы, построенных в прямоугольных координатах. Для взаимных четырехкомпонентных систем целесообразно применять способ вторичной проекции во всех случаях, когда система не содержит инконгруэнтных точек. Если же в системе имеются инконгруэнт-ные точки, графические расчеты упрощаются при построении четырехкомпонентных диаграмм способом Енеке - Ле Шателье. Концентрация растворов в данном случае выражается по 3-му способу - через массу солей в молях или ионах, сумма которых принята за единицу или за 100; масса воды выражается через число молей, отнесенных к постоянной массе солей. [2]
 |
Проекции изотермы ( безводная и водная системы КС1 - NaCl - MgCl2 - H2O при 25 С. [3] |
Вильнянский и Банных [26, 28] предложили для диаграмм четверных простых и взаимных систем ( когда состав выражен в вес. [4]
Особенностью описания является также преимущественное использование неправильного тетраэдра для построения диаграмм четырехкомпонентных простых и взаимных систем при выражении составов в массовых процентах. [5]
Сдвиг равновесия в сторону стабильной пары Li2 ( OH) 2 - Na2CrO4 вполне подтверждается диаграммой взаимной системы ( рис. 9) и позволяет ее отнести к классу необратимо-взаимных систем. [6]
При полной карбонизации аммонизированных рассолов в соответствии с уравнением ( 24) процесс теоретически может быть проанализирован в равновесных условиях с помощью диаграммы взаимной системы NaCl NHJiCOs NaHCOa N Cl. [7]
Следует отметить, что в рассматриваемой системе стабильной парой солей является NaCl KzSCu. При построении диаграмм взаимных систем с применением ионных концентраций растворов нестабильность пар солей не имеет значения. [8]
По этим показателям на диаграмму системы наносят точки R, соответствующие солевой массе исходного раствора, в котором КС1 и Na2SC4 находятся в стехиометрическом соотношении. В этом состоит особенность построения диаграмм взаимных систем с инконгруэнтными точками при выражении концентраций жидкой фазы в массовых процентах ( см. стр. [9]
Главной особенностью графических расчетов кристаллизации с помощью квадратной диаграммы Енеке - Ле Шателье является то, что во всех областях линии кристаллизации представлены прямыми линиями. Обменная реакция, которая протекает в процессе кристаллизации в некоторых областях диаграммы взаимных систем, содержащих инконгруэнтные точки насыщения, не изменяет прямолинейности линий кристаллизации. Это объясняется тем, что в данном методе концентрации жидкой фазы выражаются в ионных процентах. При выражении состава системы в массовых процентах некоторые линии кристаллизации имеют перегибы при пересечении диагонали. Это заметно усложняет графические расчеты. [10]
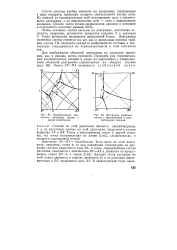 |
Прямоугольная диаграмма взаимных систем с двумя эвтектиками.| Диаграмма взаимных. [11] |
Чтобы отложить состав системы на диаграмме, достаточно отложить, например, количество процентов анионов А и катионов X. Такая диаграмма называется диаграммой Енеке. Диаграммы взаимных систем строятся так же, как и диаграммы простых тройных систем. На плоскости квадрата изображаются составы, а температура откладывается на перпендикулярной к этой плоскости оси. [12]
Исключение составляют лишь взаимные системы с инконгру-энтными точками насыщения. В тех случаях, когда кристаллизация сопровождается химическими реакциями, протекающими в инконгруэнтных областях диаграммы, линии кристаллизации на диаграммах первого типа имеют перегиб в точках их пересечения с координатными осями. При этом точки перегиба и направление линий кристаллизации могут быть определены частично графически, частично расчетным путем. Это заметно усложняет исследование процессов кристаллизации с применением диаграмм первого типа, в то время как на диаграммах взаимных систем, построенных по третьему типу ( способ Енеке - Ле Шателье) и содержащих инконгрузнтные точки насыщения, линии кристаллизации во всех областях диаграммы сохраняют свою прямолинейность. Это объясняется тем, что в данном способе состав жидкой фазы выражается в ион-эквивалентах. В случае реакций обменного разложения расчет процессов кристаллизации по диаграммам Енеке-Ле Шателье упрощается и этот метод следует предпочесть другим ( стр. [13]
Страницы: 1