Нуклеофнльная атака
Cтраница 1
Нуклеофнльная атака, предполагаемая в этом механизме, согласуется с экспериментальными данными: при введении электронодонорных заместителей ( Me, МеО) в бензофуроксан или электроноакцепторных ( С1) в нитрилоксид выход продукта реакции снижается. [1]
CN, - COOH, - СНО, - N ( CH3) a) заметно облегчают нуклеофнльную атаку, смещая к себе электронную плотность. Так, / г-хлорнитробензол реагирует с 15 % - м раствором NaOH значительно легче, чем хлорбензол ( при 160 С), а триинтрохлорбензол гидролизуется при нагревании с водой. [2]
Реакционная способность соединения ( 1) по отношению к нуклеофиль-ной атаке является следствием того, что оно представляет собой сложный эфир енола. Такие эфнры значительно реакционносиособнее по отношению к нуклеофнльной атаке, чем алкильные сложные эфиры. [3]
Присоединение брома к а ( 3-непредельным альдегидам в уксусной кислоте в присутствии хлорной или серной кислот протекает гораздо быстрее, чем аналогичное присоединение к а, 3-непредель-ным кислотам. Благодаря своей повышенной основности альдегиды вначале протонируются; следующая стадия, по-видимому, является одним из редких примеров нуклеофнльной атаки молекулы брома. Полезный реагент 2-бромакролеин ( см. разд. [4]
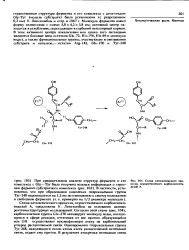 |
Схема каталитического процесса, осуществляемого карбокснпептн-даэой А. [5] |
Схема каталитического процесса, осуществляемого карбокснпептида эой А, предложена У. Согласно этой схеме ( рнс. Glu-270 активирует молекулу воды, находящуюся в сфере реакции, оттягивая от нее протон; образующийся иои ОН осуществляет нуклеофнльную атаку на карбонильный углерод расщепляемой связи. Одновременно гидроксильная группа Туг-248, находящаяся около атома азота расщепляемой пептидной связи, отдает ему протон. [6]
Влияние конформации на реакционную способность тесно связано с деталями механизма реакции. Примеры на схеме 3.2 иллюстрируют, несколько возможных путей влияния ориентации заместителя на реакционную способность. Показано, что окисление цис-4 - трег-бутилцикло-гексанола протекает быстрее чем окисление транс-изомера; при ацети-лировании отношения скоростей обратные. Скорость реакции зависит от свободной энергии активации стадии, определяющей скорость. Для ацетилирования эта стадия, по-видимому, включает нуклеофнльную атаку уксусного ангидрида гидро-ксильной группой. [7]
Страницы: 1