Атакамит
Cтраница 1
Атакамит, природный гидроксихлорид меди. [1]
Хотя структура атакамита не относится к типу слоистых структур, ее приближенно можно рассечь па плотноупакованные слои того же типа, что и в гидроксобро-мпде, описанном в разд. [2]
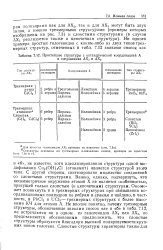 |
Простейшие структуры с октаэдрической координацией А в соединениях АХ2 и АХ3. [3] |
ОН) 3С1 ( атакамит) является структурой этого типа. С другой стороны, синтезировано множество соединений со слоистыми структурами. Важно, однако, подчеркнуть, что несимметричное окружение атомов X не является особенностью, присущей только слоистым ( и цепочечным) структурам. Оно может возникнуть и в трехмерных структурах при связывании координационных полиэдров по ребрам и граням и найдено, в частности, в РЬС12 и UC13 - трехмерных структурах с более высокими КЧ для атомов А. Не вполне понятно, почему трехмерные структуры, обозначенные знаками сносок а и б в табл. 7.12, не встречаются ни в одном из галогенидов АХ2 или АХ3, но представляется обоснованным предположить, что слоистые структуры образуются благодаря высокой поляризуемости крупных ионов галогена. [4]
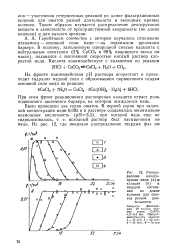 |
Распределение концентрации меди ( а в кальция ( б в твердом состоянии по длине колонки для опытов разной длительности. [5] |
А, Гарибянцем совместно с автором изучалось отложение атакамита - основной соли меди - на подвижном щелочном барьере. [6]
Структуры двух форм Си2 ( ОН) 3С1, атакамита и боталлаки-та, а также Cu2 ( OH) 3Br были описаны в разд. [8]
Характерной чертой солей меди ( П) является образование основных солей, таких, как минералы атакамит CuCl2 - 3Cu ( OH) 2 и бро-хантит CuSO4 - 3Cu ( OH) 2, а также основные карбонаты, описанные выше ( стр. [9]
 |
Схема эволюции состава продуктов коррозии нефтепромыслового оборудования 134. [10] |
Чаще всего встречаются следующие ассоциации продуктов коррозии промысловых трубопроводов: сера, гидроксиды железа, сидерит; сера, макинавит, мельниковит; иоцит, магнетит; куприт, тенорит, атакамит. Примером более сложной ассоциации является проба отложений из нефтепровода НГДУ Альметьевнефть [134], в которой, наряду с продуктами коррозии, обнаружены неорганические соли, частицы глины и кварца. [11]
Помимо этих минералов известны также кубанит CuFe2S3, теннантит Cu3AsS3 или 3Cu2S - As2S3, тетраэдрит Cu3SbS3 или 3Cu2S - Sb2S3, энаргит Cu3AsS4 или 3Cu2S As2Ss, халькостибит CuSbS2, атакамит CuCl2 - ЗСи ( ОН) 2, катангит 5CuSi03 - Cu ( OH) 2, халкантит CuS04 - 5H20, оливенит, туркоаза, халькосидерит, тиролит, халькофиллит. [12]
Отличается от ата-камита косым погасанием волокон и чрезвычайно сильным двупреломлением; у малахита лучшая спайность идет вкрест удлинения и несколько наклонно к острой биссектрисе, тогда как другая спайность обычно обнаруживает двойники по 100 с углом погасания 23 и дает обычную фигуру выхода оптической оси; у атакамита и брошантита только одна ясная спайность 010, которая параллельна удлинению и перпендикулярна к острой биссектрисе. [13]
Такие формулы абсолютно ошибочны, так как эти соединения не содержат комплексных ионов с центральным атомом меди. О структуре атакамита см. в разд. С другой стороны, в некоторых основных солях конечные комплексы, содержащие атомы металла с мостиковыми ОН-группами, действительно встречаются; далее кратко будут приведены соответствующие примеры. [14]
Хлор содержится в морской воде в виде хлорида натрия NaCl и других щелочных и щелочноземельных хлоридов ( ср. В виде таких же соединений находится он в соляных залежах, образовавшихся при высыхании морей. Иногда встречаются также хлориды тяжелых металлов, прежде всего в форме двойных соединений, таких, как атакамит 3Cu ( OH) 2 - CuClo. Бром встречается обычно вместе с хлором в виде аналогичных соединений, но в значительно меньших количествах. В аналогичном соотношении названные элементы встречаются в твердой земной коре. Иод находится в морской воде главным образом в форме органических соединений и меньше в форме иодидов. В залежах селитры Чили и Боливии иод присутствует в виде иодата, а иногда в виде периодата. Элементарный иод встречается иногда среди продуктов вулканической деятельности. [15]
Страницы: 1 2
