Диаграмма - уровни - энергия
Cтраница 3
На рис. 15 - 11 схематически изображена диаграмма уровней энергии многоэлектронного атома. Голубые кружки показывают уровни энергии для одинаковых главных квантовых чисел атома водорода. Распределение большого числа электронов по уровням энергии атома водорода приводит к сдвигу диаграммы. Орбиты имеют немного более высокую энергию, чем s - орбиты с тем же значением п; d - и / - орбиты с одним и тем же главным квантовым числом п имеют соответственно еще более высокую энергию. Уровни энергии, соответствующие 3s - и Зр-орбитам, характерны тем, что они гораздо выше, чем у 2s - и 2р - орбит, но намного меньше, чем у группы 4s -, 4р - и 3d - орбит. [31]
Выбирая, далее, масштаб в единицах В, можно строить диаграммы уровней энергии как функции одного параметра А, наглядно характеризующие электронное строение комплекса и его зависимость от силы поля лигандов. [32]
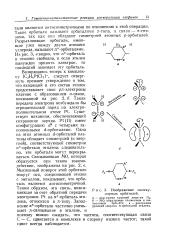 |
Изображение молекулярных орбиталей. [33] |
МО, образуемые сложением и вычитанием 2рЯ - АО; в - диаграмма уровней энергии л-орбиталей этилена. [34]
Для наглядного представления об энергетических соотношениях при образовании молекулярных орбиталей из атомных строят диаграммы уровней энергии. По вертикали вверх идет увеличение энергии орбиталей, а книзу - ее падение. [35]
Для отнесения спектральных полос к определенным электронным переходам спектроскопические данные часто сопоставляют с диаграммой вычисленных уровней энергии. Эти параметры, как будет видно из дальнейшего, определяют разность энергий термов по Расселу-Саундерсу. Однако экспериментальные данные и вычисленные значения обычно плохо согласуются друг с другом, к тому же они очень немногочисленные. Если это так, то среднее расстояние между d - электронами в закомплексованном ионе должно увеличиваться, что логически приводит к признанию увеличения размеров некоторых d - орбиталей. В настоящее время объяснение о распухании d - электронного облака вследствие перекрывания d - орбиталей атома металла с орбиталями лиганда общепринято. Этот эффект называют нефелоксетическим ( от греч. Вследствие этого эффекта уменьшается эффективный заряд ядра в атоме металла и от него частично удаляются d - электроны. По изменению этого эффекта можно составить ряд лигандов, более или менее не зависящий от атома металла. [36]
Из рассмотренного примера иона Mn2 ( d5) в слабом октаэдри-ческом поле видно, что знание диаграмм уровней энергии как функции А для данного комплекса является вполне достаточной основой для общей интерпретации наблюдаемых в нем сцектров, если речь идет об электронных переходах d - d - типа. [37]
Легко видеть, что это схематическое изображение полностью отвечает как это, конечно, и должно быть) точной диаграмме уровней энергии для Hjj ( см. фиг. [38]
Эти результаты приведены на диаграмме уровней энергии рис. 3.11. Качественной особенностью диаграммы является то, что она типична для всех диаграмм уровней энергии, показывающих энергии МО, образованных между двумя атомами, каждый из которых предоставляет одну орбиталь. Если две атомные орбитали не соответствуют одной и той же энергии, то i) a и - фь должны быть смещены приблизительно на одинаковое расстояние выше и ниже средней энергии двух атомных орбиталей. Атомные орбитали связывающихся атомов помещены по краям, а образующиеся МО показаны в середине. [39]
Для того чтобы быстро обозреть всю совокупность сведений об атоме, которые мы, таким образом, получаем, удобнее всего пользоваться диаграммами уровней энергии. Здесь горизонтальными прямыми отмечены различные энергетические состояния. По мере увеличения k расстояние между последовательными уровнями уменьшается и в пределе обращается в нуль. Выше места слияния расположена сплошная область неквантованных положительных энергий. Справа и слева помещены шкалы энергий и термов. Отсчет по той и другой шкале делается от места слияния уровней, но так как для квантованных состояний энергии отрицательны, а термы положительны, то энергия убывает снизу вверх, а термы ( равные работе ионизации) возрастают в том же направлении. На той же диаграмме стрелками показаны возможные переходы между уровнями и отмечены образующиеся при этом серии. Каждая серия возникает при переходе на нижний уровень со всех вышележащих уровней. [40]
 |
Диаграммы уровней анергии, соответствующих ионизации атомов магния. [41] |
Оторвать больше одного электрона от атома натрия или больше двух электронов от атома магния очень трудно, так как в этом случае затрагиваются орбиты, расположенные гораздо ниже на диаграмме уровней энергии. [42]
Из изложенного следует, что теоретическое объяснение спектра бензола является пока лишь частично удовлетворительным. Однако другие детали диаграммы уровней энергии остаются пока не совсем ясными и едва ли можно надеяться, что сейчас можно провести расчеты, которые позволят разобраться в этих неясных вопросах. [43]
Рассмотрим с помощью круга Фроста прежде всего уровни энергии бензола, а затем и некоторых других циклических сопряженных полиенов - циклобутадиена и циклооктатетраена. На рис. 12.2 приведены диаграммы уровней энергии Ti-орбнталей бензола, циклобутадиена и 1 3 5 7-циклооктатетраена. [44]
Страницы: 1 2 3 4 5
