Атом - неон
Cтраница 1
Атом неона имеет две заполненные оболочки. Первая - это - оболочка гелия из двух электронов, имеющая диаметр около 0 2 А, как показано на рис. 5.8, вторая - это окружающая ее внешняя оболочка из восьми электронов, называемая оболочкой неона или L-оболочкой. [1]
 |
Электронные оболочки инертных газов. [2] |
Атом неона состоит из ядра, двух - электронов во внутренней оболочке и восьми L-электроное во внешней оболочке. Аргон, кроме К - и L-обо-лочек, имеет еще одну оболочку из 8 электронов, называемую М - оболочкой. [3]
Атом неона имеет две оболочки. Первая - это оболочка гелия из двух электронов, имеющая диаметр около 20 пм ( как показано на рис. 5.3), вторая - это окружающая первую внешняя оболочка из восьми электронов, называемая оболочкой неона или L-оболочкой. Диаметр внешней оболочки равен примерно 200 пм. [4]
Атомы неона имеют возбужденное состояние, лежащее чуть меньше, чем на 165 - 103 см 1 выше основного состояния. [5]
Атомы неона имеют возбужденное состояние, лежащее чуть меньше, чем на 165 - 103 еж-1 выше основного состояния. [6]
 |
Четырехуровневая схема квантового генератора. [7] |
Атомы неона переходят именно на уровень 2S согласно условию минимального изменения общей внутренней энергии системы. Эти переходы приводят к значительной инверсии населенностей уровней 25 и 2Р, в результате чего между ними возникает индуцированное излучение. Существует большое количество примеров получения индуцированного излучения. [8]
Атомы неона не могут образовывать обычные химические связи. Между ними могут возникать лишь слабые взаимодействия типа ван-дер-ваальсовых сил, которые прямо пропорциональны поляризуемости и обратно пропорциональны потенциалам ионизации атомов. Теплота парообразования, определяемая межатомными силами, невелика ( 1 84 кДж / моль) и силы межатомного притяжения легко преодолеваются. Слабые межатомные силы обусловливают легкость перевода неона в газообразное состояние, изкие температуры плавления и кипения и небольшую ( всего в 3) разницу между точками плавления и испарения. Высокая степень притяжения внешних электронов определяет большое значение энергий ионизации и невозможность получения положительных ионов. Полная занятость валентных электронных уровней указывает на невозможность присоединения электронов, а незанятые электронные уровни сильно отличаются по энергиям от основного состояния, и это свидетельствует о трудности изменения электронной структуры неона. Инертность благородных газов, таким образом, обусловлена особенностью электронной конфигурации. [9]
У атома неона замкнутая электронная оболочка: на двух энергетических уровнях находятся соответственно 2 и 8 электронов. Химическая инертность неона исключительна. В этом с ним может конкурировать только гелий. Пока не получено ни одного его валентного соединения. Даже так называемые клатратные соединения неона с водой, гидрохиноном и другими веществами получить и сохранить очень трудно. [10]
Переход атома неона с верхнего уровня 3 на один из нижних уровней 2 приводит к лазерному излучению с К 0 6328 мкм. [11]
Переход атома неона с верхнего уровня 3 на один из нижних уровней 2 приводит к лазерному излучению с А, 0 6328 мкм. [12]
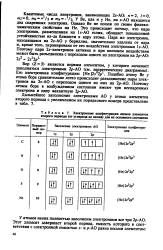 |
Электронные конфигурации атомов элементов второго периода ( от углерода до неона для их основного состояния. [13] |
У атомов неона полностью заполнены электронами все три 2 / - АО. [14]
Уровни атомов неона, обозначенные 3s и 2s на фиг. Зр при комнатной температуре почти не населены. [15]
Страницы: 1 2 3 4