Атом - третье
Cтраница 1
Атомы третьего и последующих периодов периодической таблицы образуют также связи с d - электронами. При этом осуществляется квадратное или октаэдрическое расположение связей, о котором речь пойдет в связи с изучением комплексных соединений. [1]
Рассмотрим далее электронные конфигурации атомов следующего третьего периода. Атомы первых восьми элементов третьего периода обладают следующими электронными конфигурациями ( см. схему на стр. [2]
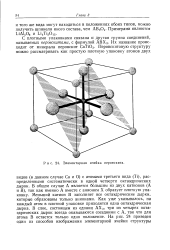 |
Элементарная ячейка перовскита. [3] |
Са и О) с атомами третьего вида ( Ti), распределенными систематически в одной четверти октаэдрических дырок. В общем случае А является большим из двух катионов ( А и В), так как именно А вместе с анионом X образует плотную упаковку. Меньший катион В заполняет все октаэдрические дырки, которые образованы только анионами. Как уже указывалось, на каждый атом в плотной упаковке приходится одна октаэдрическая дырка. В слое, состоящем из единиц АХ3, три из четырех октаэдрических дырок всегда оказываются соседними с А, так что для атома В остается только одно положение. [4]
Поведение е ( 3s2) для атомов третьего периода совершенно подобно поведению е ( 2s2) для атомов второго периода. [5]
Правило октета сохраняет также некоторое значение и для атомов третьего периода и даже еще более тяжелых. Так, например, арсину или стибину можно приписать структуры, подобные приведенной выше для фосфина, с использованием четырех s - и р-орбит валентной оболочки центрального атома. У переходных элементов для образования кова-лентных связей часто привлекаются некоторые из ( / - орбит предпоследнего слоя, наряду с s - и р-орбитами последнего валентного слоя. [6]
Проведенный выше расчет показывает, что можно ожидать значительного влияния примеси атомов третьего элемента, внедренных в междоузлия бинарного сплава, на процесс распада. [7]
Так, для атомов второго периода в качесте остовной используют двукратно заполненную орбиталь ls - типа, тогда как для атомов третьего периода остов дополняется орбиталями 2s - и 2р - типа. Такое подразделение на остовные и валентные орбитали достаточно условно, особенно для тяжелых атомов; оно может быть проведено подчас по-разному, в зависимости от поставленной задачи с включением меньшего или большего числа орбиталей в число валентных. [8]
Двух-электронные возбуждения и виртуальные Зй-орбитали можно не учитывать в парной корреляционной функции и ( 3s2), Поведение е ( 3s2) для атомов третьего периода совершенно подобно поведению е ( 2s2) для атомов второго периода. [9]
Сравнительно меньший радиус атомов углерода и азота обусловливает большее перекрывание я - типа между их р-ор-биталями и доступными для перекрывания р-орбиталями атомов кислорода, в результате чего образуются прочные я-связи. Так как атомы третьего и последующих периодов обладают намного большими размерами, перекрывание их р-орбиталей с р-орбиталями атомов кислорода оказывается значительно более слабым и я-связи между этими атомами играют гораздо меньшую роль. [10]
 |
Модели плотной шарот вой упаковки. [11] |
На рис. 1.8. последовательность чередования слоев типа АВСАВС соответствует КПУ - ( кубической плотнрупакованной, или ГЦК для атомов одного сорта, см. рис. 1.4, в), а типа АВАВ - ГПУ - ( гексагональной плотноупакованной, см. рис. 1.6) решеткам. Отметим, что атомы третьего слоя в положениях А и С не могут находиться в одной плоскости. [12]
Будем теперь строить линейную цепочку атомов, присоединяя к уже имеющимся еще по одному атому. При присоединении к двум атомам Li третьего атома три валентных электрона трех атомов Li сольются в одну электронную оболочку, близкие уровни которой, как и в случае двух атомов, будут заполнены имеющимися электронами лишь частично. [13]
 |
Валентные структуры карбонат-иона.| Межатомные расстояния для связей С-О и N-О. [14] |
Все приведенные выше примеры достаточно хорошо иллюстрируют применение метода ВС для описания я-связей в молекулах, образуемых атомами второго периода. Применение метода ВС к простым соединениям, образуемым атомами третьего и дальнейших периодов, не будет здесь рассмотрено, так как проблема ря-связей в подобных соединениях не является особенно важной. [15]
Страницы: 1 2 3