Присоединившийся атом
Cтраница 1
Присоединившиеся атомы водорода расположены на одной стороне молекулы. [1]
Здесь присоединившийся атом образует наибольшее число связей - связи с тремя ближайшими атомами. Следующей энергетически выгодной позицией для присоединения атома служит торец ступени ( положение 2), поскольку здесь образуются связи с двумя ближайшими атомами. Учет атомов во второй координационной сфере приводит к некоторым энергетическим различиям для атомов. [2]
 |
Схематическое изображение двухмерного зародыша на растущей грани. [3] |
Положение присоединившегося атома более благоприятно, если он примыкает к уже законченному ряду ( атом, отмеченный крестиком на рис. 10, б), так как в этом случае у него имеются два ближайших соседа. Еще больший выигрыш энергии получается, если атом становится в положение, отмеченное крестиком на рис. 10, в, когда атом продолжает начатый ряд, соприкасающийся с ранее заполненным; в этом случае атом имеет уже трех ближайших соседей. [4]
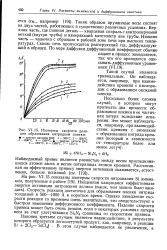 |
Изотермы скорости реакции образования нитридной пленки. [5] |
Наблюдаемый привес является разностью между весом присоединившихся атомов азота и весом потерянных атомов кремния. [6]
Когда присоединение к сопряженной системе идет в положение 1 4, то присоединившиеся атомы или группы в данных условиях способны в свою очередь к отщеплению с возникновением первоначальной системы из двух двойных связей, аналогично тому, как могут быть получены снова этиленовые соединения из продуктов присоединения. [7]
Лоран отмечает также, что в некоторых случаях при действии хлора на органические соединения число присоединившихся атомов хлора может быть большим или меньшим числа замещенных атомов водорода. [8]
В интервале температур 300 - 1130 С в присутствии кислорода она может окисляться, удерживая в пустотах кристаллической решетки присоединившиеся атомы кислорода, которые имеют значительно больший диаметр, чем атомы урана. При температуре от ИЗО до 2500 С двуокись урана может восстанавливаться с образованием дефектной структуры, в которой присутствует избыток атомов урана. [9]
Число электронов, которыми обладают атомы угле рода, соечиненпые кратной связью, увеличивается в результате приобретения по одному электрону вместе с каждым присоединившимся атомом водорода. [10]
Объяснение может состоять в том, что а-тетрахлорид образуется по реакции, аналогичной процессу присоединения хлора к фенантрену. Первая молекула хлора начинает присоединяться в положение 1 ( конец бутадиеновой системы); так как сопряжение отодвигает образовавшийся заряд карбониевого иона далеко от положения 2, то первый присоединившийся атом хлора не образует электростатической связи с этим положением, а второй атом хлора не диссоциирует, а присоединяется в tywc - положение. Поскольку заряд первоначально образовавшегося карбониевого иона оттягивается от положения 4 менее сильно, происходит частичная диссоциация хлорид-иона; поэтому происходит образование б-тетрахлорида путем тпрякс-присоединения хлорида в количестве, которое может увеличиваться при добавлении хлорид-ионов; ацетокситрихлорид образуется в результате аналогичного торакс-присоединения ацетат-иона из растворителя - уксусной кислоты. [11]
В настоящем разделе рассмотрены механизмы двух разных реакций присоединения водорода к циклическим соединениям - к двойной или ароматической связям. Сравнительно недавно выяснилось, что существует особый тип реакций присоединения атомов водорода к цик-лоалканам, при котором число Н - атомов в молекулах не меняется, поскольку каждому присоединившемуся атому водорода соответствует другой атом водорода, уходящий из молекулы. Такие реакции и вопрос о том, происходят ли эти присоединения и отрывы одновременно или последовательно, рассмотрены в следующем разделе. [12]
 |
Электронные плотности р-электронов. [13] |
Если один атом образует простые связи с двумя или тремя другими атомами при помощи р-электронов, то направления валентных связей должны располагаться в пространстве под углом 90 в соответствии с ориентацией электронных облаков. Однако существуют факторы, которые несколько искажают этот угол. К ним относится отталкивание между присоединившимися атомами, отталкивание между полярными связями с одинаковыми по знаку зарядами. [14]
В результате d - орбитали атома фосфора заняты электронами слабо, эффективный положительный заряд на фосфоре достаточно велик и нуклеофильная атака молекулы спирта или амина на фосфор протекает легко. В дальнейшем, после выделения фенола, при фосфоре остается алкокси - или диалкиламиногруппа и занятость его d - орбиталей увеличивается за счет более сильного ( р - () я-взаимодей-ствия. Атака второй и тем более третьей молекулы спирта требует более жестких условий, а вторая молекула амина в реакцию вообще не вступает, так как р-электроны первого присоединившегося атома азота взаимодействуют с d - орбиталями фосфора настолько сильно, что не допускают второй атаки молекулы амина. Это можно объяснить тем, что фениламиногруппа сравнительно слабо подает р-электроны азота на й-орбитали фосфора и для запирания реакции нужны по меньшей мере две фенил аминогруппы. [15]
Страницы: 1 2