Сближающийся атом
Cтраница 2
Конденсация гелия в жидкость при низких температурах обязана так называемым ван-дер-ваальсовым силам, которые возникают при взаимной электростатической поляризации сближающихся атомов. [16]
Геометрическое расположение частиц в элементарном акте ( их конфигурация) определяется максимальным перекрыванием электронных орбиталей реагирующих атомов при минимальном отталкивании сближающихся атомов. [17]
Энергия обменного отталкивания АЕ0вм обязана тому, что в силу Паули принципа электроны с одинаковыми спинами избегают друг друга; это приводит к уменьшению электронной плотности в пространстве между ядрами двух сближающихся атомов Н н В в молекулах КАН и ВК, вследствие чего эти ядра меньше экранируются электронами, чем в своб. Энергия поляризации ДЕПол обязана в осн. [18]
Совершенно так же особое механическое движение атомов, возникающее при их химическом соединении и передаваемое затем другим внешним молекулам при столкновении с ними, является чем-то новым, появившимся за счет потенциального силового поля сближающихся атомов. Возникающее и передаваемое во внешнюю среду тепловое движение есть нечто материальное, имеющее Свою энергию и массу, но его еще труднее, чем фотон, наглядно представить себе осколком атома или молекулы. Фотона не было в атоме до излучения, но он, по крайней мере, может быть свободным и самостоятельно ( от породившего его атома) передвигаться в пространстве. Тепловое движение отрывается от данного атома и переходит к другому только в момент столкновения: оно способно как бы только перейти с одного атома на другой как нечто материальное или как своеобразный вид материи, самостоятельно от движущихся частиц, однако, не существующий. [19]
Разрыхляющими называются такие орби-тали, заселение которых способствует диссоциации молекул. Рассмотрим ls - орбитали двух сближающихся атомов водорода и предположим, что эти волновые функции имеют противоположные знаки. При сближении атомов область положительных амплитуд одной орбитали вторгается в область отрицательных амплитуд другой. В соответствии с законами волновой механики интерференция волновых функций приводит к уменьшению результирующей амплитуды в области перекрывания. Поскольку квадрат амплитуды волновой функции определяет плотность вероятности нахождения электронов, это уменьшение касается и ее. [20]
Химические свойства атомов и молекул, выражающиеся в их способности вступать во взаимодействие друг с другом, обусловлены состоянием имеющихся в них электронов, В более простых случаях реагирующих атомов главную роль в химическом взаимодействии играют валентные электроны внешних оболочек. Если при взаимодействии атомных орбиталей двух сближающихся атомов возникает связывающая молекулярная орбиталь, то это эквивалентно образованию химической связи и образованию устойчивой молекулы с минимумом внутренней энергии ( см. также гл. [21]
В зависимости от ориентации спинов обобществленных электронов обменное взаимодействие может приводить к образованию либо сил притяжения, либо сил отталкивания. Если спины параллельны, то между сближающимися атомами возникают силы отталкивания, и молекула не образуется. [22]
При сближении атомов происходит взаимное перекрытие электронных оболочек и между атомами возникают силы электростатического взаимодействия. Важной характеристикой взаимодействия является изменение потенциальной энергии сближающихся атомов. [23]
Однако необходимо иметь в виду, что эта кривая определяет зависимость потенциальной энергии системы двух атомов от расстояния между ними лишь для случая, когда сближение или удаление атомов происходит вдоль одной прямой линии. В общем случае это не имеет места, так как сближающиеся атомы обладают относительным моментом импульса, что соответствует вращению с двумя степенями свободы. Поэтому к значениям потенциальной энергии, определяемым по кривой рис. 34, следует прибавить кинетическую энергию вращения для каждого квантового состояния и для каждого расстояния между атомами. В результате этого на кривой энергии может появиться максимум, подобный изображенному на рис. 35, где кривая / представляет собой исходную кривую потенциальной энергии, а кривая / / - полученную путем сложения потенциальной и вращательной энергии. Для каждого значения вращательного квантового числа получаются различные кривые, но общий вид кривой во всех случаях остается неизменным. [24]
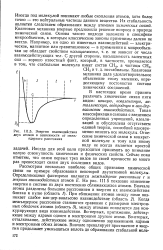 |
Энергия взаимодействия двух атомов в зависимости от межъядерного расстояния. [25] |
Рассмотрим несколько наиболее общих признаков химической связи на примере образования некоторой двухатомной молекулы. На рис. III.5 показано изменение энергии в системе из двух постепенно сближающихся атомов. Когда межъядерное расстояние становится сравнимо с размерами электронных оболочек атомов ( область 3), между атомами появляется два конкурирующих вида взаимодействия. Во-первых, притяжение, действующее между ядрами одного и электронами другого атома. Во-вторых, отталкивание, действующее между одноименно заряженными ядрами и электронами обоих атомов. [26]
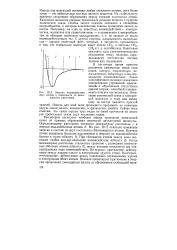 |
Энергия взаимодействия двух атомов в зависимости от межъядерного расстояния. [27] |
Рассмотрим несколько наиболее общих признаков химической связи на примере образования некоторой двухатомной молекулы. На рис. II 1.5 показано изменение энергии в системе из двух постепенно сближающихся атомов. Когда межъядерное расстояние становится сравнимо с размерами электронных оболочек атомов ( область 3), между атомами появляется два конкурирующих вида взаимодействия. Во-первых, притяжение, действующее между ядрами одного и электронами другого атома. Во-вторых, отталкивание, действующее между одноименно заряженными ядрами и электронами обоих атомов. [28]
Обсудим теперь физический смысл выражений (7.4) и (7.5), основываясь на рассмотрении пространственного распределения электрона и его энергии. На рис. 7.7, а показано распределение вероятности для электронов на ls - орбиталях сближающихся атомов А и В. По существу на этом рисунке изображено то же самое, что и на рис. 5.6, а, где было показано распределение вероятности для ls - электрона изолированного атома, но в данном случае распределение вероятности для каждого из двух ls - электронов показано в обоих направлениях от ядер атомов А и В вдоль межъядерной оси. [30]
Страницы: 1 2 3 4
