Соприкасающийся атом
Cтраница 2
Так, на модели рис. 2 поверхностный гидрид ( или хемосорбированный водород) характеризуется положением атома водорода в ямке М, окруженной тремя атомами катализатора, тогда как при гидрогенизации активен атом водорода, расположенный в ложбине только между двумя соприкасающимися атомами катализатора. [16]
Геометрическое соответствие необходимо для тесного сближения реагентов и рабочих центров катализатора. Соприкасающиеся атомы реагента и катализатора образуют промежуточный комплекс, в котором первоначальные связи деформированы. [17]
Ван-дер-ваальсовы радиусы определяют кратчайшие расстояния между атомами, не связанными хим. связью. Их находят, пользуясь принципом аддитивности, из расстояний между соприкасающимися атомами соседних молекул в кристаллах. В пределах одной молекулы ван-дер-ваальсовы сферы валентно связанных атомов перекрываются. В кристалле молекулы, моделируемые таким способом, образуют плотную упаковку. Они характеризуют также эффективные размеры атомов в кристаллах отвердевших благородных газов. [18]
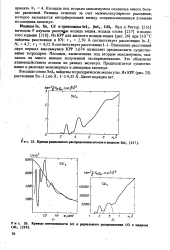 |
Кривые интенсивности ( а и радиального распределения ( б в жидком CdI2. [19] |
Разница отнесена за счет межмолекулярного рассеяния, которое вызывается интерференцией между соприкасающимися атомами из соседних молекул. [20]
Разумеется, эти допущения выполняются лишь приближенно. Так, вариации межмолекулярных расстояний зависят от ориентации межатомного вектора, соединяющего центры соприкасающихся атомов разных молекул, относительно направлений валентных связей между атомами. Возможны и отклонения участков поверхности, ограничивающих молекулу от сферической формы, что может быть вызвано анизотропией колебаний молекулы в кристалле. [21]
По его мнению, никакой принципиальной разницы между аморфной и кристаллической фазами нет, и непонятно, почему Н. И. Кобозев настаивает на этом различии. Если взять два аморфных атома, то это не кристаллическая и не аморфная фаза, а это - соприкасающиеся атомы. [22]
Если считать, что молекулы в кристаллических структурах соприкасаются друг с другом, то их размеры можно определить как сферы действия сил Ван-дер - Ваальса, относящихся к определенным атомам. Межмолекулярный вандерваальсов радиус атома, вычисленный из сферы действия атома, принадлежащего определенной молекуле, равен половине расстояния между идентичными соприкасающимися атомами разных молекул. [23]
Значения энтропии плавления кристаллов благородных газов называют в свою очередь что следует также учитывать такие лады в изменение энтропии при плавлении, которые обусловлены юцессами разупорядочения, рассмотренными несколько выше. Эти авторы рассмотрели щель, в которой кристалл с плотно упакованной кубической решет - й разупорядочивается при плавлении вследствие взаимного оттал-вания соприкасающихся атомов. Было рассчитано изменение энтро-ш, сопровождающее каждую из трех стадий плавления. [24]
Но соединение атомов в молекулу определяется не только возможностью образовать систему с минимальной энергией, но еще и специфическими законами микромеханики, выраженными принципом Паули. Согласно этому принципу на одной орбите могут двигаться два электрона с антипараллельными спинами. Следовательно, общие орбиты между двумя атомами способны образовать только непарные электроны соприкасающихся атомов. [25]
При этом разрушается кристаллическая решетка и образуется жидкая металлическая ванна 3, общая для двух свариваемых заготовок, называемая сварочной ванной. Поверхностные пленки разрушаются или всплывают на поверхность сварочной ванны. Жидкий металл смачивает оплавленные поверхности, что обеспечивает возникновение межатомных связей между соприкасающимися атомами жидкой и твердой фаз. На второй стадии при охлаждении происходит кристаллизация с образованием межатомных связей. [26]
В своей самой простой форме она исходит из следующих предпосылок: если рассмотреть в кристалле два иона, располагающихся в непосредственной близости друг от друга, то, как известно, взаимное проникновение их электронных оболочек приводит к их отталкиванию. Если эти ионы поместить в электрическое поле, то их электронные оболочки будут деформироваться ( эффект поляризации) и деформация изменит силу отталкивания ионов. В то же время - и это очень важно - взаимное отталкивание между соприкасающимися атомами, проявляющееся на малых расстояниях, может привести к поляризации другого рода - деформационной поляризации, которая в свою очередь приведет к эффектам большого радиуса действия. Оболочечная модель позволяет учесть эти эффекты. [27]
Чем объясняется то или иное поведение атомов при их соприкосновении, в результате которого между элементами возникает химическая связь. Полная энергия электронов и атомов состоит из потенциальной и кинетической энергий. Потенциальная энергия определяется притяжением электронов к ядру, и она тем меньше, чем сильнее притягивается электрон к ядру; кинетическая энергия электрона, наоборот, тем больше, чем сильнее электрон притягивается к ядру. Специальный расчет показывает, что потенциальная энергия электрона в данном состоянии в два раза превышает его кинетическую энергию, поэтому полная энергия электрона определяется в основном его потенциальной энергией. Вследствие этого при соприкосновении атомов электроны стремятся образовать общие орбиты вокруг обоих ядер соприкасающихся атомов, так как притяжение каждого электрона к двум близко расположенным ядрам уменьшает потенциальную энергию, а значит, и общую энергию электронов в атомах ( увеличивается сцепление электронов с ядрами вследствие того, что возрастает суммарный положительный заряд ядер); таким путем образуется молекула из атомов, соединенных друг с другом общими электронами. [28]
Чем объясняется то или иное поведение атомов при их соприкосновении, в результате которого между элементами возникает химическая связь. Полная энергия электронов и атомов состоит из потенциальной и кинетической энергий. Потенциальная энергия определяется притяжением электронов к ядру, и она тем меньше, чем сильнее притягивается электрон к ядру; кинетическая энергия электрона, наоборот, тем больше, чем сильнее электрон притягивается к ядру. Специальный расчет показывает, что потенциальная энергия электрона в данном состоянии в два раза превышает его кинетическую энергию, поэтому полная энергия электрона определяется в основном его потенциальной энергией. Вследствие этого при соприкосновении атомов электроны стремятся образовать общие орбиты вокруг обоих ядер соприкасающихся атомов, так как притяжение каждого электрона к двум близко расположенным ядрам уменьшает потенциальную энергию, а значит, и общую энергию электронов в атомах ( увеличивается сцепление электронов с ядрами вследствие того, что возрастает суммарный положительный заряд ядер); таким путем образуется молекула из атомов, соединенных друг с другом общими электронами. [29]
Как же взаимодействуют частицы воздуха. Вскрыв на ряде примеров полную несостоятельность гипотезы о существовании особой упругой жидкости, Ломоносов пишет: Все это доказывает с полной очевидностью, что сила упругости воздуха происходит от какого-то непосредственного взаимодействия его атомов. Но непосредственное взаимодействие атомов требует их соприкосновения, их контакта. В то же время известно, что воздух может быть сжат в более чем тридцатикратно меньший объем. Это, по мнению Ломоносова, говорит о том, что между атомами воздуха существуют промежутки, не заполненные собственной его материей, и в них может поместиться очень много таких атомов. Получаются, пишет Ломоносов, два на первый взгляд противоречивые, но тем не менее вполне правильные положения. С одной стороны, атомы должны соприкасаться между собой, а с другой - они, по существу, должны находиться на некотором удалении друг от друга. Это противоречие Ломоносов разрешает тем, что вводит представление о временном, мгновенном взаимодействии соприкасающихся атомов. [30]
Страницы: 1 2