Соседний атом
Cтраница 3
Электронные облака соседних атомов углерода перекрываются над и под плоскостью кольца. [31]
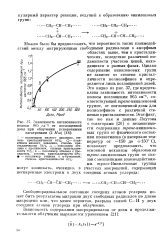 |
Зависимость интенсивности. [32] |
Свободнорадикальное состояние соседних атомов углерода может быть результатом миграции двух свободных радикалов по длине макроцепи или, что менее вероятно, разрыва связей С - Н у двух соседних атомов углерода при облучении. [33]
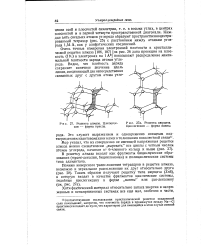 |
Решетка алмаза. Цмклогек-сан - форма кресла. [34] |
Каждые пять соседних атомов углерода образуют пространственноцентри-рованьый тетраэдр ( рис. 25) с расстоянием между атомами углерода 1 54 А, как у алифатических соединений. [35]
Наличие у соседних атомов углерода нескольких электроноак-цепторных нитрильных групп определяет возможность протекания таких реакций, в которые нитрилы обычно не вступают. Значительный электронный дефицит двойной связи тетрацианэтилена обусловливает способность этого соединения участвовать в реакциях окисления - восстановления. [36]
Пространственное положение соседних атомов относительно данного атома можно определить посредством установления межатомных расстояний и углов между различными связями, образованными атомом. По некоторым причинам целесообразно рассмотреть отдельно кова-лентные и ионные связи. Одна из причин заключается в том, что следует изучать стереохимию ионов в твердом теле, где мало молекул конечных размеров или комплексных ионов, содержащих в основном ионные связи. Число электронов, приобретаемых или теряемых атомом при образовании иона, зависит от электронной структуры атома, но когда ион уже образовался, способ упаковки ионов в кристалле определяют только геометрические факторы и условие электронейтральности. Известно, что количество соседних атомов, например у иона 02 -, в различных кристаллах изменяется в широких пределах, в частности, рядом с ионом О2 - находятся три иона Ti4l - в ТЮ2, 4 иона Th44 в ТЮ, 6 ионов Mg2 в MgO и 8 ионов К в К2О, а далее будет показано, что эффективный радиус иона изменяется с его координационным числом. Однако максимальное число ковалент-ных связей, которое может образовать данный элемент, очень ограничено, потому что электроны, служащие в качестве связей, одновременно являются частью орбитальной электронной структуры атома, причем существует определенный предел числа электронов, могущих занимать внешнюю оболочку атома. При этом максимальное число ковалентных связей ограничено, а фактически может образоваться число связей меньше максимального. Поэтому следует выяснить: 1) можно ли подобрать ряд ковалентных радиусов, сумма которых дала бы длину ковалентной связи между каждыми двумя рассматриваемыми атомами, и 2) зависит ли этот ковалентный радиус от числа образованных связей. Для этого прежде всего необходимо точно знать, какие электроны принимают участие в образовании данных связей. При определении длины ковалентных связей и углов между ними нет надобности рассматривать отдельные молекулы и кристаллы. [37]
Расстояние между соседними атомами в атомных сетках принимают одинаковым и равным 1 42 А. Считают, что ячейки этих сеток имеют форму равносторонних шестиугольников, как в графите. Однако известно, что расстояния между атомами в ароматических конденсированных структурах варьируют в пределах 1 34 - 1 46 А в зависимости от места атомов в структуре. [38]
Расстояние между соседними атомами в плоскости плотной упаковки кристаллического графита равно 1.42 А, расстояние между плоскостями 3.35 А. Атомы в соседних плоскостях сдвинуты относительно нормали к плоскости, и только атомы каждой второй плоскости расположены один над другим. Можно думать, что внутри плоскости атомы связаны валентной связью. Связь же между плоскостями определяется силами типа Ван-дер - Ваальса. [39]
Расстояние между соседними атомами равно а, а жесткость связей между ними к. [40]
Между двумя соседними атомами, углерода, находящимися в состоянии рЗ - гибридизации, устанавливается, как известно, не только обычная о-связь, но и вторая связь особого типа. [41]
Расстояние между соседними атомами в слое равно 0 218 нм, а между слоями 0 368 нм. [42]
Расстояние между соседними атомами углерода в плоскости плотной упаковки кристаллического графита равно 1.42 А, расстояние между плоскостями - 3.35 А. Атомы в соседних плоскостях расположены в шахматном порядке. [43]
 |
Тетраэдрическое расположение связей, образуемых атомом углерода. [44] |
Если между соседними атомами углерода возникают двойные или тройные связи, вместо те-траэдрических структур образуются другие формы ( см. разд. В качестве примера приведем данные о соединениях с двумя углеродными атомами и атомами водорода, иллюстрирующие основные различия между простой, двойной и тройной углерод-углеродными связями. [45]
Страницы: 1 2 3 4