Крупный атом
Cтраница 2
Однако силан и н-ок-такозан проявили одинаковую устойчивость, показывая тем самым, что замещение атома углерода более крупным атомом кремния уменьшает стерическое напряжение в точке ответвления. [16]
Однако силан и и-ок такозан проявили одинаковую устойчивость, показывая тем самым, что замещение атома углерода более крупным атомом кремния уменьшает стерическое напряжение в точке ответвления. [17]
Однако силан и н-ок такозан проявили одинаковую устойчивость, показывая тем самым, что замещение атома углерода более крупным атомом кремния уменьшает стерическое напряжение в точке ответвления. [18]
Силициды переходных металлов в отличие от других тугоплавких бескислородных соединений не принадлежат к фазам внедрения, так как крупные атомы кремния не могут внедряться в поры металлических решеток. Структуры силицидов образованы по типу замещения атомов металла атомами кремния. Для многих силицидов характерны слоистые структуры с довольно резкими разделениями слоев из атомов металла и атомов кремния, что облегчает сдвиговое деформирование и понижает кри-поустойчивость при повышенных температурах. [19]
Они образуют главным образом сложные цепочечные слоистые и каркасные структуры и не образуют металлоподобных фаз внедрения, так как крупный атом кремния ( 0 117 нм) не может вместиться в простую по строению кубическую решетку металла. [20]
В частности, для фторидов с малыми размерами атома фтора имеет большое значение поляризация, в особенности при комбинации наиболее крупного атома цезия со фтором. Эта поляризация, упрочняя связь, укорачивает межъядерное расстояние и, таким образом, способствует большому втягиванию атома фтора внутрь атома цезия. На рис. 210 - 212 никак не отражены изменения электронных облаков, зависящие от обменного эффекта антисимметризации или от поляризации, но втягивание центра атома фтора в оболочку щелочного металла и замедление в росте межъядерного расстояния заметны. [21]
А оболочки из этих атомов, окружающие молекулу углеводорода ( рис. 11), не экранируют внутреннее силовое поле; более крупные атомы фтора ( ковалентный радиус 0 64 А), по-видимому, создают эффективный экран, защищающий молекулу фторуглерода от воздействия какой-либо вторгающейся молекулы. [22]
Рид [6], ссылаясь на изменения минералов при таких процессах, как гранитизация и метаморфизм, недавно высказал мысль, что крупные атомы кислорода решетки силикатов остаются более или менее в одном и том же положении, тогда как небольшие подвижные атомы проскакивают через них. [23]
Следует отметить, что растворимость малых кристаллов выше растворимости частиц с радиусом г, поскольку атомы с их поверхности переходят к более крупным атомам. Протекает процесс, аналогичный рекристаллизации, определяемой стремлением системы к уменьшению энергии. [24]
Если исходить из электроотрицательности, то можно было бы ожидать, что наиболее стабильным является комплекс с SiCl4, однако пространственное влияние крупного атома хлора должно снижать стабильность; в данном случае оно является преобладающим. [25]
Во всех этих соединениях проявляется тенденция небольшого по размеру атома фтора образовывать одиночные, а не двойные мостики; последние характерны для более крупных атомов хлора и брома ( см. стр. [26]
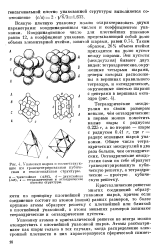 |
Упаковки шаров и соответствующие им гранецснтрпрованиая кубическая п гексагональная структуры. [27] |
Кристаллические решетки многих соединений образуются по принципу плотнейшей упаковки шаров, причем если соединение состоит из атомов ( ионов) разных размеров, то более крупные атомы образуют решетку с плотнейшей или близкой к плотнейшей упаковкой, а атомы меньших размеров занимают тетраздрические и октаэдрические пустоты. [28]
В целом, в присутствии двух тг-углеродных систем из 4, 5, 6 или 7 атомов комплексы почти всегда имеют сандвичевую структуру ( или тетраэдрическую в соединениях с крупными атомами М), а в присутствии одной тг-системы - обычно тетраэдрическую координацию, если считать, что тг-система занимает одно координационное место. [29]
Так как радиусы атомов Si, В, С и N составляют соответственно 1 18; 0 91; 0 77; 0 71 А, то следовало ожидать, что значения энергий активации диффузии для крупных атомов кремния и бора будут большими, чем для атомов углерода и азота. Однако экспериментально обнаруживается обратная картина ( рис. 4), которая, с известным приближением, может быть объяснена, исходя из рассмотрения механизма диффузионного процесса. [30]
Страницы: 1 2 3 4