Нормальный атом
Cтраница 1
 |
Тетраэдрические атомы, образующие одинарную, двойную и тройную связи. [1] |
Нормальный атом углерода имеет лишь два неспаренных электрона, и поэтому может образовывать только две нова-лентные связи. [2]
 |
Схемы нульвалентно.| Схемы энергетических уровней водородного и многоэлектронного атома. [3] |
Нормальный атом азота имеет три одиночных, валентных электрона и потому трехвалентен. [4]
Нормальный атом вершины в полигональных или полиэдрических молекулах предоставляет для скелетного связывания 3 внутренние орбитали. Так, например, некоторые кластеры переходных металлов, расположенных в конце соответствующих рядов переходных элементов в периодической-системе, такие, как [ Rh5 ( CO) 15 ] -, имеют атомы вершин, предоставляющие для кластерного связывания только 2 внутренние орбитали. [5]
Концентрация нормальных атомов азота и углерода за фронтом ударной волны может быть определена по методу, использованному для определения сечения фотоионизации атомарного углерода и атомарного азота. Как известно, сечение фотоионизации и сечение поглощения для атомарных газов совпадают. [6]
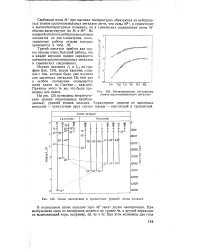 |
Ионизационные потенциалы атомов щелочноземельных металлов.| Схема синглетных и триплетных уровней атома кальция. [7] |
В нормальном атоме кальция терм 4s2 занят двумя электронами. [8]
Так как нормальный атом гелия не может образовать валентную связь с атомом водорода, то долина, параллельная оси абсцисс, на рис. 27 исчезает. Вместо нее появляется высокое плато с неглубокой долиной, обусловленной ван-дер-ваальсовскими силами, и лежащее в области относительно больших значений г2 ( около 3 8 А); при малых значениях г2 поверхность резко повышается. Большая область, способствующая реакции между тремя атомами водорода, а именно долина, параллельная оси абсцисс, здесь заменяется высоким плато. Превращение колебательной энергии, соответствующей у2, в поступательную энергию движения вдоль координаты xlt которое играет существенную роль для стабилизации системы Н2 - - Н, образованной из ЗН, для системы 2H - f - He является гораздо менее вероятным. Если материальная точка, представляющая систему 2H - j - Не, обладает достаточной поступательной энергией в направлении xv то возможно превращение последней в колебательную энергию, соответствующую движению вдоль у2, и в этом случае Н2 - - Не может образоваться, как показано на стр. [9]
При возбуждении нормального атома углерода его исходная конфигурация 2s2p2 перестраивается в 2sp3, а затем образуются четыре гибридных 5р3 - облака, в каждом из которых содержится по 25 % s - характера и 75 % р-характера. [10]
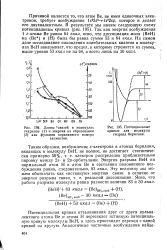 |
Длины связей в молекулах. [11] |
Энергия разрыва ВеН на нормальный атом Н и атом Be в состоянии половинного возбуждения равна, следовательно, 83 ккал. Ясно, что работа разрыва молекулы равна разности величин 83 и 30 ккал. [12]
Эти термы возбуждения в нормальных атомах пусты. Для сравнения также приведены уровни возбужденных состояний атома водорода. Занятый в нормальном атоме водорода терм Is не изображен, так как в масштабе графика он лежит очень глубоко. Наоборот, для всех атомов щелочных металлов это вырождение вблизи от заполненных уровней ( и в самой области заполнения тем более) снимается. [13]
Чтобы в обратном процессе сталкивающиеся нормальные атомы His вместо образования основного состояния молекулы Н 2 Sg породили ре-пульсивное состояние HH3S ц, необходимо столкновение частиц, приближающихся друг к другу с большой скоростью. [14]
Как видно, рост концентрации нормальных атомов N уменьшает первое и увеличивает второе слагаемое в (10.1), так что возможны случаи, когда суммарная полуширина линии будет оставаться почти неизменной. [15]
Страницы: 1 2 3 4