Доля - обмен
Cтраница 2
Вполне естественно, что с ростом т ускорение стремится к 1, так как в общем времени выполнения алгоритма возрастает доля обменов по сравнению со временем вычислений. Вместе с тем для разных методов ускорение падает по-разному. Наилучший результат, опять же, наблюдается для метода умножения матрицы на вектор. Наиболее чувствительны к этому параметру оказались методы L [ / - разложения и декомпозиции области решения трех-диагональных систем. [16]
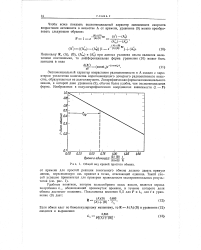 |
Общий вид кривой простого обмена. [17] |
Удобным понятием, которое целесообразно здесь ввести, является период полуобмена Л, , обозначающий промежуток времени, в течение которого доля обмена достигает половины. [18]
В принципе при исследовании реакции простого гомогенного обмена в определенных условиях, для расчета периода полуобмена и скорости обмена [ см. уравнение ( 9) ] достаточно одного опыта; однако практически всегда рекомендуется проводить определение доли обмена в течение различных отрезков времени. Подчинение полученных данных экспоненциальному закону обмена является наилучшей проверкой их надежности. [19]
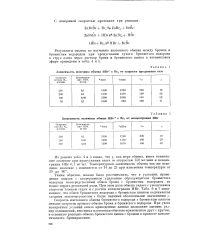 |
Зависимость величины обмена НВг с Вг2 от скорости продувания газа.| Зависимость величины обмена НВг с Вг2 от концентрации НВг. [20] |
Таким образом, можно было рассчитывать, что в условиях проведения опытов с непрерывным удалением образующегося бромистого водорода непосредственный обмен брома с бромистым водородом не может играть решающей роли. При этом доля обмена падает с увеличением скорости газовой струи и с ростом концентрации НВг. [21]
Вычисленные для механизмов ( 1 К) и ( 2 К) содержания О18 в уксусной кислоте при обмене в карбониле на 50 %, приведенные в таблице, качественно согласуются с найденными. В таблице также приведены доли обмена z, при которых согласие было бы полным. Они находятся в пределах величин, которые нужно было ожидать согласно данным об обмене. [22]
К - соответственно время обмена и константа скорости обмена, зависящая от соотношения фаз ( газ: адсорбированная фаза) и независящая от состава газа. Результаты расчетов показали, что в области изменения доли обмена от 0 до 0 7 экспериментальные данные ложатся на прямую, а затем наблюдается отклонение от прямой. [23]
Обмен в LiBr03 идет с измеримой кинетикой. На рисунке приведена зависимость - In ( 1 - z) от времени, где z - доля обмена от равновесного, для 120 и 140 С в растворах, содержащих около 1 3 г соли на 1 г воды. Из них видно, что щелочь заметно не влияет на скорость обмена. [24]
Физические методы разделения имеют два недостатка. Для того чтобы осуществить разделение, часто требуется сравнительно много времени, в течение которого может произойти заметный обмен, даже если сам процесс разделения не оказывает ускоряющего влияния на обмен. Вследствие того что полное разделение реагирующих веществ обычно практически неосуществимо, при проведении расчетов необходимо вводить поправку на неполноту разделения. Для этой цели может быть использовано уравнение ( 22), при условии что S равно измеренной удельной активности химической фракции, обогащенной одним из реагирующих веществ, S0 - рассчитанной удельной активности той же фракции при t 0 ( удельной активности, которой бы обладала эта фракция, если бы обмен не имел места), a F - доле обмена реагирующих веществ в этой обогащенной химической фракции до и во время разделения. [25]
Для проверки этого предположения был поставлен ряд обменных опытов. После этого половина ржавчины гидрировалась для определения количества окислов в ней, а вторая половина после высушивания на воздухе погружалась в тяжелокислородную воду. Степень обмена находилась из содержания О18 в воде до обмена и в окислах после него. Этим путем можно было находить долю обмена, не прибегая к более полному высушиванию окислов, ведущему к сильному изменению их структуры. [26]
Страницы: 1 2