Доля - доступная поверхность
Cтраница 1
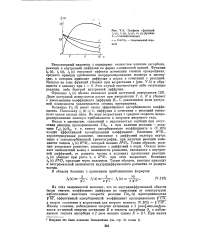 |
Графики. функций. [1] |
Доля доступной поверхности растет при уменьшении Г, А, Л и убывает с уменьшением коэффициента диффузии Dr. С увеличением доли доступной поверхности увеличивается степень превращения. [2]
По мере уменьшения СА / СТ доля доступной поверхности стремится к величине, отвечающей реакции первого порядка, идущей без изменения объема. [3]
Адсорбционные системы очень трудно описать теоретически, поскольку коэффициенты распределения в основном зависят от природы и доли доступной поверхности адсорбента, которую трудно воспроизвести в различных опытах. [4]
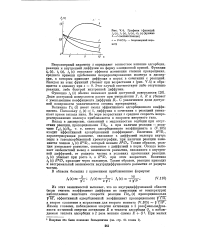 |
Графики. функций. [5] |
Доля доступной поверхности растет при уменьшении Г, А, Л и убывает с уменьшением коэффициента диффузии Dr. С увеличением доли доступной поверхности увеличивается степень превращения. [6]
В действительности речь идет только о случаях, когда h изменяется в пределах примерно от 1 до 3 - 4, так как при более высоких h F ( h) изменяется слабо. Естественно, что доля доступной поверхности / не зависит от того, рассматривается ли одна пора или их совокупность, если все гранулы катализатора имеют одинаковые размеры. Однако для вычисления общей скорости реакции необходимы более детальные сведения о пористой структуре катализатора. [7]
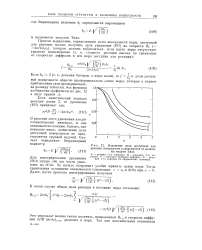 |
Изменение доли доступной для реакции поверхности в зависимости от величины модуля Тиле. [8] |
В решение этого уравнения входит эллиптический интеграл, и оно оказывается сложным. Однако, как показано ниже, вычисление доли доступной поверхности не представляется трудной задачей. [9]
Можно видеть, что уравнения ( 168) и ( 169) содержат на две независимые-переменные больше, чем в рассмотренном ранее случае изотермической диффузии. К числу таких дополнительных независимых переменных относятся-показатель степени в уравнении Аррениуса ( EIBT) и функция экзотермич-ности - & НОс0 / кТ0, которые Вейсс и Хикс [48] обозначают символами у и р соответственно. Решения для этих уравнений были получены путем построения графика изменения величины отношения скоростей ингибирован-ной и неингибированной реакций ( ранее это отношение называлось долей доступной поверхности, однако для неизотермических реакций его лучше-называть фактором эффективности) в зависимости от модуля Тиле для сферических таблеток cps R VkJDe при у и Р, служащих постоянными параметрами. [10]
Это может сказаться а наших результатах следующим образом. Основное уравнение ( 69) выведено из уравнения ( 68), которое дает значение константы скорости на единицу объема катализатора из экспериментальных данных по активности. Если диффузия к наружной поверхности катализатора настолько медленна, что влияет на скорость реакции, то уравнение ( 68) не дает действительной средней активности, а дает лишь кажущуюся активность, которая меньше действительной. Пользуясь этой неверной величиной активности, мы получим долю доступной поверхности, которая окажется большей, чем действительная. Можно воспользоваться следующим практическим методом, который заключается в том, что в правую часть уравнения ( 68) вводится фактор ( Нт - f - HF) / HR, где Яд и Ну - величины, определенные Хартом [28], могут быть вычислены по его способу. Эта поправка необходима в случае очень быстрых реакций. [11]
По избирательности действия нитридные железные катализаторы значительно отличаются от восстановленных, карбонизированных или индуцированных катализаторов. Нитриды приводят к образованию продуктов более низкого молекулярного веса, среди которых присутствует значительная часть кислородсодержащих органических соединений. Это различие в селективности, повидимому, обусловлено наличием или отсутствием е-нитрид-ной или s - карбонитридной фаз. Активность азотированных катализаторов равна или значительно выше активности катализаторов, предварительно обработанных другими способами. Однако нельзя утверждать, что присущая е-нитридам и е-карбонитри-дам активность выше активности других фаз железа, поскольку молекулярный вес продукта в значительной степени определяет долю доступной поверхности катализатора. [12]
Здесь уместно рассмотреть влияние температуры на скорость адсорбции. Если в уравнении ( 134) член h ( 1 - 6) велик, то скорость реакции просто равна скорости диффузии ( при градиенте концентрации c0 / QL) в ту часть поры, которая не покрыта адсорбатом. При этих условиях кажущаяся энергия активации ( см. разд. При достаточно низкой температуре, когда скорость настолько мала, что поддается определению, константа скорости k достаточно мала, чтобы значение Ад было также низким. Поэтому в данном случае доля доступной поверхности близка к единице и может наблюдаться истинная энергия активации. [13]
Страницы: 1