Кривая - совместная кристаллизация
Cтраница 1
Кривая совместной кристаллизации начинается на стороне AgCl - КС) при 318 и оканчивается при 440 - 450 внутри тройной системы. [1]
Кривая совместной кристаллизации NaCl и твердых растворов на основе NasCOs почти горизонтальна, вероятен незначительный максимум. Расплавы в области, богатой Кта2СОз СаСОз, очень вязки, при охлаждении - стеклообразные. СаСОз, выделяющийся в области sgP, при 690 ( точка Р) полностью реагирует с расплавом. [2]
Линия II-II - кривая совместной кристаллизации двух солей NaCl и NH4C1 - политермическая кривая. [3]
Линия II-И - кривая совместной кристаллизации двух солей NaCl и NH4C1 - политермическая кривая. [4]
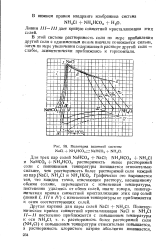 |
Политерма взаимной системы NaCl NH4HCO3 NaHCO3 NH4CI. [5] |
Линия / / / - / / / дает кривую совместной кристаллизации этих солей. [6]
Поверхность ликвидуса тройной взаимной системы состоит из двух полей твердых растворов CdCl2 - CdBra и РЬС12 - РЬВг2, кривая совместной кристаллизации которых имеет минимум при 338 С и 85 - 90 % бромидов. [7]
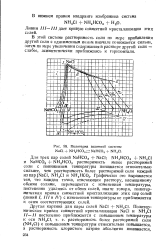 |
Политерма взаимной системы NaCl NH4HCO3 NaHCO3 NH4CI. [8] |
Графически это выражается тем, что каждая точка, отвечающая раствору, насыщенному обеими солями, перемещается с изменением температуры, постепенно удаляясь от обеих солей, иначе говоря, политермическая кривая совместной кристаллизации этих пар солей ( линий /, / / / и IV) с изменением температуры не приближается к осям соответствующих солей. [9]
Поверхность ликвидуса ( рис. 152) представляет поле кристаллизации тройных твердых растворов, которое вблизи системы Т1С1 - T1J расщепляется на два поля ограниченных тройных твердых растворов. Кривая совместной кристаллизации двух родов ограниченных тройных твердых растворов начинается в эвтектике двойной системы Т1С1 - T1J при 309 и обрывается внутри системы. [10]
Приведенная на рис. 15 диаграмма позволяет ориентироваться в направлении процессов, протекающих при получении мочевины, поэтому рассмотрим ее более подробно. Кроме изотерм ( тонкие линии), на диаграмме нанесены кривые совместной кристаллизации ( пограничные линии), которые делят ее на четыре области. Поле, примыкающее к вершине NH4COONH2, соответствует области насыщенных по отношению к карбамату аммония растворов всех трех компонентов системы. К вершине CO ( NH2) 2 примыкает область растворов, насыщенных по отношению к мочевине. [11]
Поверхность ликвидуса ( рис. 206) состоит из поля AgCl или его твердых растворов с NaCI и поля твердых растворов К. При приближении к стороне AgCl - NaCI оба поля сливаются. Кривая совместной кристаллизации начинается на стороне AgCl - КС1 при 318 ц оканчивается при 440 - 450 внутри тройной системы. [12]
Сторонами треугольника являются диагональ ( ЫВ02) 2 - ( КС1) а и триангулирующие сечения ( LiB02) 2 - Dx и ( КС1) 2 - Dx. В треугольнике ( LiB02) 2 - DI - ( КС1) 2 ( рис. IX.3, б) установлены четыре поля кристаллизации: метабората лития, хлорида калия, соединения Dx и хлорида натрия. Область расслоения покрывает большую часть поверхности поля метабората лития. Поле хлорида натрия, занимая 5 % всей площади, отделяет поле соединения Dt. Это подтверждается и тем, что в найденной тройной точке сходятся кривые совместной кристаллизации полей метабората лития, хлорида натрия и хлорида калия. [13]
Сторонами треугольника являются диагональ ( LiB02) 2 - ( КС1) а и триангулирующие сечения ( LiB02) 2 - Dx и ( КС1) 2 - Da. В треугольнике ( LiB02) a - Dt - ( KC1) 2 ( рис. IX.3, б) установлены четыре поля кристаллизации: метабората лития, хлорида калия, соединения Dx и хлорида натрия. Область расслоения покрывает большую часть поверхности поля метабората лития. Поле хлорида натрия, занимая 5 % всей площади, отделяет поле соединения Dx. Это подтверждается и тем, что в найденной тройной точке сходятся кривые совместной кристаллизации полей метабората лития, хлорида натрия и хлорида калия. [14]
Следует отметить, что усыхание раствора возможно не только в тройной точке. Например, точка исходного раствора п ( рис. 22.1) лежит на диагонали СЕ в поле кристаллизации соли AY. В точке е выделяются соли AY и ВХ, причем в том же соотношении, в каком они находятся в растворе, поэтому состав раствора и не меняется до усыхания. Точка е окажется конечным пунктом кристаллизации при изотермическом испарении и она является единственной. Такие точки всегда существуют, когда диагональ квадрата стабильной пары солей пересекает кривую совместной кристаллизации этой же пары солей. [15]
Страницы: 1 2