Диаграмма - давление - пар
Cтраница 3
Это очень полезное уравнение, поскольку, пользуясь им, можно получить данные по давлению насыщенного пара практически для всех веществ в довольно широком интервале температур с приемлемой точностью, и для определения констант требуются только две экспериментальные точки. Для азота совпадение почти полное во всем интервале сосуществования жидкости и пара. Это особенно замечательно потому, что ни одно из трех допущений, на которых основывается уравнение, даже приближенно не является действительным для столь большого интервала. Копсон и Фролих [47] представили диаграмму давления пара для восьми низших углеводородов в интервале примерно от 0 001 атм до критического давления при использовании координат Igp и 1 / Т, причем отклонение от прямой линии оказалось небольшим. [31]
Гомогенные жидкие системы представлены на основе современных теоретических или экспериментально найденных закономерностей. Рассмотрены системы только из жидких веществ при обычной или лишь немного повышенной температуре. Эти системы имеют много общего, почему их рассмотрение в курсе физико-химического анализа уместно. Еще более общими являются положения, связанные с гетерогенными равновесиями - диаграммами расслаивающихся жидких систем, а также с диаграммами давления пара и температуры кипения. [32]
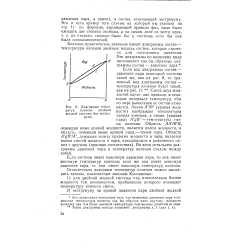 |
Диаграмма температур кипения двойной жидкой системы без экстремума. [33] |
Большое практическое значение имеют диаграммы состав - температура кипения двойных жидких систем, которые строятся для постоянного давления. Смесь двух жидкостей кипит, как правило, в некотором интервале температур, ибо по мере выкипания ее состав изменяется. Линия A lB ( кривая жидкости) изображает температуры начала кипения, а линия ( кривая пара) A gB - температуры конца кипения. Во всем остальном диаграммы давления пара и температур кипения сходны между собой. [34]
 |
Политерма тройной системы. [35] |
Таким образом, будут зафиксированы два из четырех независимых параметров - концентрации двух солей. Восстановим из каждой точки треугольника перпендикулярные отрезки, длины которых соответствуют температурам насыщения растворов, имеющих составы, изображаемые точками оснований перпендикуляров. Кривые поверхности насыщения ( рис. 3.10), являющиеся множеством верхних концов перпендикулярных отрезков, образуют пространственную фигуру внутри треугольной призмы. Такая пространственная диаграмма, дающая зависимость состояния системы и состава насыщенных растворов от температуры, называется политермой. В этой диаграмме давления пара не отображены. [36]
 |
Способ отсчета состава смеси. [37] |
Так м образом, будут зафиксированы два из четырех независимых параметров - концентрации двух солей. Восстановим из каждой точки треугольника перпендикулярные отрезки, длины которых соответствуют температурам насыщения растворов, имеющих составы, изображаемые точками оснований перпендикуляров. Кривые поверхности насыщения ( рис. 5.18), являющиеся множеством верхних концов перпендикулярных отрезков, образуют пространственную фигуру внутри треугольной призмы. Такая пространственная диаграмма, дающая зависимость состояния системы и состава насыщенных растворов от температуры, называется политермой. В этой диаграмме давления пара не отображены. На эту грань точка плавления льда R и все другие точки, лежащие на ребре А А, не проектируются. [38]
Страницы: 1 2 3