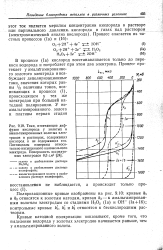
Поляризационная кривая
Cтраница 1
Поляризационные кривые не изменяются при наличии в пробе благородных металлов, а также кадмия, цинка и более электроотрицательных элементов. [1]
Поляризационные кривые могут быть построены экспериментально даже для сложных случаев коррозии, отвечающих практическим условиям работы пары. [2]
Поляризационные кривые получают регистрацией потенциала коррозии и коррозионного тока с помощью двухкоординатно-го самопишущего прибора с логарифмическим преобразователем. Определяют плотность коррозионного тока, пропорциональную скорости коррозии исследуемого металла, экстраполяцией участка Тафеля до значения потенциала коррозии на поляризационной кривой. [3]
Поляризационные кривые ( катодные): а - при электролитическом цинковании; / - кислый электролит: / / - щелочный ( цинкатный) электролит; / / / - цианистый электролит; б - при электролитическом меднелии; I - кислый электролит; / / - цианистый электролит. [4]
Поляризационные кривые для стали 20 в неингибировашюй и ингибированной промысловой жидкости Мортымья-Тетеревского месторождения до и после магнитной обработки представлены на ряс. [5]
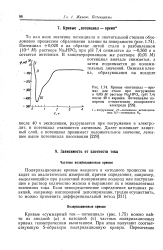 |
Кривая потенциал - - время для стали при погружении в 0 05 М раствор Na2HPO4 ( рН 7 4 после 40 ч аэрации. Потенциалы измерены относительно водородного электрода. [6] |
Поляризационные кривые анодного и катодного процессов находят из аналитических измерений, причем определяют, например, выделяющийся при различной поляризации водород или поступающее в раствор количество железа и выражают их в эквивалентных значениях тока. [7]
Поляризационные кривые указывают на анодную пассивность в растворах бикарбонатов натрия и кальция. [8]
Поляризационные кривые изображены на рис. 9.10: кривые ki и &2 относятся к золотым катодам, кривая k3 - к амальгамированным золотым электродам со стадиями Н202 ( 1а) и ОН ( 1а 1б); контрольные кривые k, k % и fe относятся к бескислородным растворам. [10]
Поляризационные кривые имеют асимптотический характер. Поэтому полной защиты железа при этом достичь нельзя; незначительное растворение, соответствующее значению / ар все же происходит. [11]
Поляризационные кривые, полученные для электролитов с различной концентрацией цианистого калия и едкого натра, имеют участок предельного тока, соответствующий почти полной пассивации анода. Увеличение концентрации цианистого калия и едкого натра приводит к повышению предельной плотности тока. При малой концентрации едкого натра ( 12 Г / л), после достижения пассивного состояния анода, дальнейшее повышение плотности тока приводит к быстрому росту потенциала и падению силы тока до нуля. На аноде образуется белая солевая пленка, не проводящая ток. При более высоких концентрациях щелочи на аноде образуется пленка темно-коричневого цвета, которая проводит ток и после выключения тока постепенно растворяется в электролите. [12]
 |
Поляризационные кривые в 3 5 н. растворах ( NH4 2SO4 и H2SO4 при 7 С.| Поляризационные кривые в 4 5 н. растворах ( NH4 2SO4 и H2SO4 при. [13] |
Поляризационная кривая / на рис. III.1, снятая на платиновом аноде в сернокислотных растворах, содержащих сульфат аммония, имеет два участка, разделенных переходной областью. Нижний участок поляризационной кривой ( при потенциалах анода менее 2 В) соответствует процессу выделения кислорода. Образование кислоты начинается лишь при потенциалах выше 2 В. Однако Смит и Хугленд пытаются дать иное толкование сложного характера анодной поляризационной кривой, имеющей участки с различными наклонами. [14]
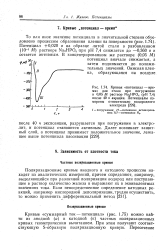 |
Кривая потенциал - - время для стали при погружении в 0 05 М раствор Na2HPO4 ( рН 7 4 после 40 ч аэрации. Потенциалы измерены относительно водородного электрода. [15] |
Страницы: 1 2 3 4 5