Пептидной атом
Cтраница 1
Участие пептидного атома азота в полидентатном хелатообра-зовании определяется двумя геометрическими условиями. Допускаются только небольшие искажения нормальной тригональной конфигурации связей у атома азота. Металл и атомы пептидной группы должны быть почти копланарны. [1]
В то время как координированные пептидные атомы кислорода геометрически не могут образовать более чем одно пяти - или шес-тичленное хелатное кольцо, координация по депротонированному пептидному атому азота создает идеальную конформацию лиган-дов для сближения двух смежных хелатных колец, имеющих общую связь металл - пептидный азот. [2]
По мере того как число донорных пептидных атомов азота, связанных с ионами Си ( II), увеличивается, главный d - d - переход Си ( II) сдвигается в более коротковолновую область. [3]
При наличии дизамещенных атомов азота в системе отсутствуют пептидные атомы водорода, способные образовывать водородную связь. Если в таких цепях возможно образование стабильной спиральной структуры ( как мы увидим из приводимых ниже результатов, для большинства из них это именно так), то стабилизация таких структур должна осуществляться не за счет водородных связей, а вследствие других взаимодействий. [4]
Подобно Ni ( II), двухвалентные ионы этих металлов вызывают ионизацию пептидных атомов водорода. Они образуют квадратно-пласкостные комплексы, в которых местами связывания металла являются депротонирован-ные пептидные атомы азота. По мере продвижения сверху вниз в группе периодической системы стабилизация кристаллического поля донорами более сильного поля увеличивается и, следовательно, повышается эффективность ионов металлов в лабилизации пептидных протонов. Положение атомов водорода в этом комплексе установлено методом дифракции нейтронов, так что нет сомнения в том, что пептидные группы депротонированы, в то время как карбоксильная группа еще нейтральна. Отсюда не следует, что в связывании [ PtCl4 ] 2 - с белками всегда участвуют депротонированные пептидные группы, так как пептидные атомы азота в белках обычно менее доступны, чем в растворенных молекулах пептидов. [5]
Изучение взаимодействия между пептидами и Ni ( II) помогает получить представление о связывании металла пептидными атомами азота в комплексах Cu ( II) - пептид. Существование комплекса Ni ( II), в котором пептидные группы депротонированы, подтверждено препаративным [68], потенциометрическим 60, 69 - 71 ], ИК-спектроскопическим [60] и кристаллографическим [72] исследованиями; все они дают результаты, очень похожие на те, что получены для системы Си ( II) - пептиды. Термодинамическая устойчивость комплексов Ni ( II) - пептиды несколько ниже, чем устойчивость соответствующих Си ( II) - пептидных комплексов. [6]
Донорными атомами, которые в хелате чаще всего соседствуют с пептидным азотом, являются атомы азота аминогруппы или пептидные атомы азота на конце с МН2 - группой, а также пептидный азот, пептидный кислород, карбоксильный кислород, атом азота гистидина ( имид-азольный) или атом серы метионина ( тиоэфирный) на конце с СОО-группой. [7]
Ряд методов подтверждает существование в растворах металлов с пептидами пятичленных хелатных колец, в которых донорами являются атомы азота аминогрупп и пептидные атомы кислорода. При добавлении ионов Cd2 к раствору один сигнал сдвигается сильнее, чем другой. Это доказывает, что первоначальные места хелатообразования для Cd2 и Си2 одни и те же. До сих пор эксперимент лишь идентифицировал протоны, которым соответствуют определенные частоты в спектрах ЯМР, при этом предполагалось, что донорные группы известны. Распространяя эти подходы на комплексы Cd ( II) с аминокислотами и пептидами с боковыми цепями, можно дать расшифровку, которая не зависит от этого предположения. [8]
Строго говоря, имеются только два комплекса, в которых путем анализа кристаллической структуры доказано отсутствие хе-латообразования при взаимодействии ионов металлов с пептидными атомами кислорода. [9]
В то время как координированные пептидные атомы кислорода геометрически не могут образовать более чем одно пяти - или шес-тичленное хелатное кольцо, координация по депротонированному пептидному атому азота создает идеальную конформацию лиган-дов для сближения двух смежных хелатных колец, имеющих общую связь металл - пептидный азот. [10]
Кооперативная природа перехода от [ NiL ] к: [ NiH 2L ] - обусловлена изменением координации от октаэдрической к квадратно-плоскостной, при этом изменение координационной геометрии обусловлено усилением поля лигандов по мере того, как пептидные атомы азота связываются с металлом. Комплексы Ni ( II) либо октаэдрические и парамагнитные, либо квадратно-плоскостные и диамагнитные. Для них в отличие от Cu ( II) не наблюдается постепенного изменения геометрии. Более сильному полю лигандов в квадратно-плоскостной конфигурации способствует повышение ЭСКП. [11]
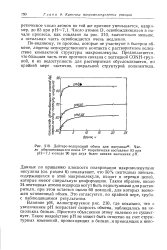 |
Дейтеро-водородный обмен для инсулина62. Число обменивающихся ионов D теоретически составляет 83 при рН7 1 и около 90 при двух более низких значениях рН. [12] |
Данные по вращению плоскости поляризации макромолекулами инсулина ( см. раздел 6) показывают, что 50 % пептидных звеньев, содержащихся в этой макромолекуле, входят в отрезки цепей, которые имеют спиральную конформацию. Таким образом, около 24 пептидных атомов водорода могут быть недоступными для растворителя, при этом остается около 60 позиций, для которых возможен мгновенный обмен. Это согласуется, по крайней мере, грубо, с наблюдавшимся результатом. [13]
Подобно Ni ( II), двухвалентные ионы этих металлов вызывают ионизацию пептидных атомов водорода. Они образуют квадратно-пласкостные комплексы, в которых местами связывания металла являются депротонирован-ные пептидные атомы азота. По мере продвижения сверху вниз в группе периодической системы стабилизация кристаллического поля донорами более сильного поля увеличивается и, следовательно, повышается эффективность ионов металлов в лабилизации пептидных протонов. Положение атомов водорода в этом комплексе установлено методом дифракции нейтронов, так что нет сомнения в том, что пептидные группы депротонированы, в то время как карбоксильная группа еще нейтральна. Отсюда не следует, что в связывании [ PtCl4 ] 2 - с белками всегда участвуют депротонированные пептидные группы, так как пептидные атомы азота в белках обычно менее доступны, чем в растворенных молекулах пептидов. [14]
В присутствии Си2 протон группы NHS титруется при значительно более низких рН, так как ион Си2 конкурирует с ионами Н за NH2 - rpynny. Затем в интервале рН от 5 до 10 титруются еще более трех протонов. Аналогично этому [ CuH 2L ] - не образуется, если один такой остаток занимает третье место в пептидной цепи. Это показывает, что пептидные группы являются местами дополнительной диссоциации протонов. Депротонирование приводит к тому, что пептидные атомы приобретают способность связывать металл без потери пептидом резонансной энергии. После того как депротонируются все пептидные группы, способные связывать металл, дополнительно еще могут лабилизоваться протоны координированных молекул воды. [15]
Страницы: 1 2