Атом-донор
Cтраница 1
Атом-донор, имеющий неподеленную пару электронов, предоставляет ее в общее пользование атому-акцептору. [1]
Алюминийорганические соединения легко образуют и внутрикомплек-сные соединения в том случае, когда атом-донор электронов находится в цепи углеродного радикала алюминийорганического соединения на таком расстоянии, чтобы мог образоваться пяти - или шестичленный цикл. [2]
Полярные полимеры представляют собой вещества, в молекулах которых электроны смещены от одних атомов к другим так, что атом-донор становится более электроположительным, а атом-акцептор более электроотрицательным. Такие молекулы, обладающие парой зарядов противоположного знака, находящиеся на некотором расстоянии друг от друга, называются диполями. [3]
При образовании координационной связи два электрона атома-донора в равной мере принадлежат уже двум атомам, что равносильно потере этим атомом одного электрона, следовательно, атом-донор приобретает при этом положительный заряд. [4]
Ковалентная связь по донорно-ащепторному механизму образуется при взаимодействии атомов, в одном из которых имеется неподеленная пара электронов на атомной орбитали, а в другом - свободная орбиталь. Атом-донор, имеющий неподеленную пару электронов, предоставляет ее в общее пользование атому-акцептору. [5]
Образовавшаяся донорно-акцепторная связь отличается толь -, ко способом образования; по свойствам она одинакова с остальными ковалентными связями. Атом-донор при этом приобретает положительный заряд. [6]
Образование ковалентной св зи может иметь и донорно-акцепторный механизм. В этом случае атом-донор предоставляет двухэлектронное облако, а атом-акцептор - свободную орбиталь. Донорно-акцепторные связи, называемые также координационными, возникают, например, при образовании ионов [ NHJ, [ Ag ( NH3) 2 ], [ Zn ( NH3) 4 ] 2, [ Co ( NH3) 6P и др., в которых азот молекулы аммиака, обладая неподеленной электронной парой, выполняет функцию донора, а ионы Н, Ag, Zn2 и Со3 - функцию акцептора. [7]
Образование ковалентной связи может иметь и л онорно-акцеп-торный механизм. В этом случае атом-донор предоставляет двух-электр ТЗннбе облако, а атом-акцептор - - свободную орбиталь. ТТНТРл [ Ag ( NH3) 2 ], [ Zn ( NH3) 4 ] 2f, [ CO ( NH3) e ] 3t и др., в которых азот молекулы аммиака, обладая неподеленной электронной парой, выполняет функцию донора, а ионы Н, Ag, Zn2 и Co t - функцию акцептора. [8]
В комплексах с такими лигандами атомы металлов часто находятся в состоянии низкой степени окисления - положительной, нулевой или даже отрицательной. Но эти лиганды способны стабилизировать низкие состояния окисления металлов, так как атом-донор наряду с неподеленными парами электронов имеет также и вакантные орбитали, которые могут принимать электроны с заполненных орбиталей атома металла. Образующаяся при этом я-связь дополняет а-связь, возникающую за счет неподеленной пары электронов лиганда. Таким образом, высокая электронная плотность на атоме металла, являющаяся следствием образования им а-связей с лигандами, де-локализуется на лиганды. [9]
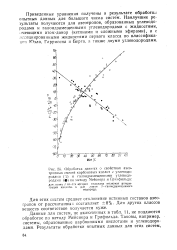 |
Обработка данных о свойствах азео-тропных смесей карбоновых кислот с углеводородами ( D и галоидзамещенными углеводородами ( по методу Мейснера и Гринфильда. [10] |
Приведенные уравнения получены в результате обработки опытных данных для большоге числа систем. Наилучшие результаты получаются для азеотропов, образованных углеводородами и галоидзамещенными углеводородами с жидкостями, имеющими атом-донор ( кетонами и сложными эфирами), и с ассоциированными жидкостями первого класса по классификации Юэла, Гаррисона и Берга, а также двумя углеводородами. [11]
Приведенные уравнения получены в результате обработки опытных данных для большого числа систем. Наилучшие результаты получаются для азеотропов, образованных углеводородами и галогенза-мещенными углеводородами с жидкостями, имеющими атом-донор ( кетонами и сложными эфирами), и с ассоциированными жидкостями первого класса по классификации Юэла, Гаррисона и Берга, а также двумя углеводородами. [12]
Приведенные уравнения получены в результате обработки опытных данных для большого числа систем. Наилучшие результаты получаются для азеотропов, образованных углеводородами и галоидзамещенными углеводородами с жидкостями, имеющими атом-донор ( кетоиами и сложными эфирами), и с ассоциированными жидкостями первого класса по классификации Юэла, Гаррисона и Берга, а также двумя углеводородами. [13]
Во многих комплексных соединениях атомы металла находятся в состоянии низкой степени окисления - положительной, отрицательной и даже нулевой. Для всех перечисленных выше лигандов характерна способность стабилизировать низкие состояния окисления металлов; это свойство лигандов обусловлено тем, что атом-донор в молекуле лиганда наряду с неподеленными парами электронов имеет также и свободные орбитали. Эти свободные орбитали могут принимать электроны с заполненных орбиталей атома металла, при этом образуется л-связь, которая дополняет а-связь, возникающую за счет неподеленной пары электронов лиганда. Таким образом, высокая электронная плотность на атоме металла ( которая является следствием низкой степени окисления) делокали-зуется на лиганды. Способность лигандов принимать электроны на пустые л-орбитали с низкой энергией можно назвать - кислотностью, употребляя термин кислотность в смысле Льюиса. [14]
Здесь из пяти валентных электронов атом азота N использовал три на образование связей с тремя атомами водорода Н, каждый из которых имел один свой электрон. Два электрона остались неиспользованными, и атом азота может в данном случае стать донором электронов. Если такой атом-донор соединен с системой сопряженных связей, то электроны оставшейся пары имеют тенденцию к вовлечению в общую семью делокализо-ванных пи-электронов. Эту тенденцию принято отмечать изогнутой стрелкой. [15]
Страницы: 1 2