Молярная доля - компонент
Cтраница 1
Молярные доли компонентов в поверхностном слое практически определить так же трудно, как и абсолютную величину адсорбции А. Если компоненты близки по адсорбционной способности, то для определении величины адсорбции А можно воспользоваться уравнением, связывающим величины Л и Г ( III. [1]
Молярная доля компонента раствора в системе жидкость - пар с изменением температуры и давления может меняться. [2]
Молярную долю компонентов в эталонах сравнения ( газовых смесях в баллонах под давлением) определяют методом прямых измерений на оптико-акустических установках, имеющих граду-ировочные характеристики. [3]
Xj молярные доли компонента соответственно в паровой и жидкой фазах. [4]
Сумма молярных долей компонентов раствора равна единице. [5]
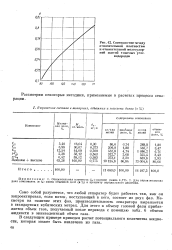 |
Соотношение между относительной плотностью и относительной молекулярной массой тяжелых углеводородов. [6] |
Для паров молярная доля компонента ( в %) равна объемной доле ( в %) и проценту парциального давления. [7]
Xi - молярная доля компонента i в растворе, не зависящая от температуры и давления. [8]
Графическая зависимость найденной молярной доли компонента А ( быстро реагирующий компонент смеси) от процентного содержания ацетона в водно-ацетоновой среде представлена кривой / на рис. 37 для смеси диэтиламин - триэтиламин, содержащей 60 3 % диэтиламина. Однако кривая 2 показывает, что в случае смеси к-бутиламина и трибутиламина ( 70 3 % н-бутиламина) добавление воды уже не помогает, и смесь этих аминов не может быть удовлетворительно проанализирована таким способом. Кроме того, трибутиламин становится нерастворимым в том случае, если в смеси присутствует более 20 % воды. [9]
Связь между молярной долей компонентов в паровой и жидкой фазах идеального раствора легко установить следующим образом. Обозначим через Nlt N2, y и г / г соответственно число молей и молярные доли первого и второго компонентов в паровой фазе, через NI, Nz, x и х2 - число молей и молярные доли первого и второго компонентов в жидкой фазе. [10]
TVj - молярной долей компонента, находящегося в жидкой фазе в наибольшем количестве, определяется выражением, включающим в себя только свойства этого компонента, а именно 7 - его точку замерзания в чистом виде ( Ni 1), АНт г - скрытую теплоту плавления в чистом виде, и ACpi, которое равно Сп ( жидк. Уравнение, данное в главе 9, приложимо к широкой области соединений. [11]
Смеси задают массовыми, объемными и молярными долями компонентов. [12]
Здесь xl - молярная доля i-то компонента, a G - его химический потенциал в чистом состоянии. [13]
Константа равновесия определяет соотношение молярных долей компонента t в паровой и жидкой фазах. [14]
Константа равновесия определяет соотношение молярных долей компонента i в паровой и жидкой фазах. [15]
Страницы: 1 2 3 4