Абсорбция - кислота
Cтраница 1
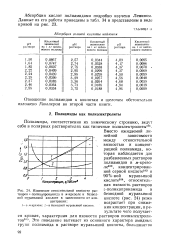 |
Абсорбция соляной кислоты найлоном.| Изменение относительной вязкости растворов Е - поликапронамида в л - крезоле и безводной муравьиной кислоте в зависимости от концентрации. [1] |
Абсорбция кислот полиамидами подробно изучена Лемином. [2]
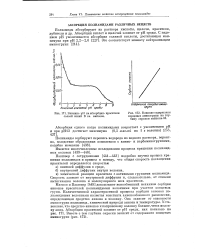 |
Влияние рН на абсорбцию красителя солвей синий В на найлоне.| Влияние содержания концевых аминогрупп на глубину окраски найлона-66. [3] |
Полиамиды абсорбируют из раствора кислоты, щелочи, красители, дубители и др. Абсорбция кислот и щелочей зависит от рН среды. [4]
 |
Образец для испытания на разрыв материала аккумуляторных баков. [5] |
Эбонитовые блоки для тяговых аккумуляторных батарей, батарей для мотоциклов и некоторые другие требуют материала большей разрывной прочности. Испытания на абсорбцию кислоты проводятся измерением и взвешиванием образцов ( 50x50 мм) до и после их выдерживания в серной кислоте удельного веса 1 300 при температуре 24 С. Сосуд с образцами на 7 суток помещается в термостат, где поддерживается температура 68 С. [6]
 |
Схема абсорбции 5Оз серной кислотой различной концентрации. [7] |
После абсорбции SO3 газовая смесь вместе с непоглощенным серным ангидридом удаляется в атмосферу. Естественно, что для уменьшения потерь SO3 с отходящими газами, а также для защиты атмосферы степень поглощения серного ангидрида в абсорбционном отделении должна быть возможно большая. Полнота абсорбции зависит от концентрации применяемой для абсорбции кислоты. [8]
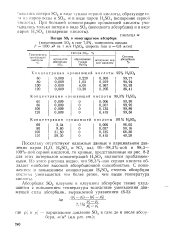 |
Потери S03 в моногидратном абсорбере. [9] |
Поскольку отсутствуют надежные данные о парциальном давлении паров Н2О, H2SO4 и SO3 над 95 - 98 3 % - ной и 98 3 - Ш0 % - ной серной кислотой, то кривые, представленные на рис. 8 - 2 для этих интервалов концентраций H. Из этого рисунка видно, что 98 3 % - ная серная кислота обладает наиболее высокой абсорбционной способностью. С понижением и повышением концентрации H2SO4 степень абсорбции кислоты уменьшается тем более резко, чем выше температура кислоты. [10]
 |
Зависимость Ко от концентрации при различной температуре кислоты.| Зависимость степени абсорбции SO3 в моногидратном абсорбере от. концентрации кислоты при различной температуре. [11] |
На рис. 71 приведены расчетные данные о зависимости степени абсорбции триоксида серы в моногидратном абсорбере от концентрации и температуры орошающей кислоты. Из этого рисунка видно, что 98 3 % - ная серная кислота обладает наиболее высокой абсорбционной способностью. С понижением и повышением концентрации H2SO4 степень абсорбции кислоты уменьшается тем более резко, чем выше температура кислоты. [12]
После абсорбции 5Оз газовая смесь вместе с непоглощенным серным ангидридом удаляется в атмосферу. Естественно, что для уменьшения потерь SO3 с отходящими газами и для защиты атмосферы степень поглощения серного ангидрида в абсорбционном отделении должна быть возможно большая. Полнота абсорбции зависит также от концентрации применяемой для абсорбции кислоты. [13]
Поскольку отсутствуют надежные данные о парциальном давлении паров Н2О, H2SO4 и SO3 над 95 - 98 3 % - ной и 98 3 - 100 % - ной серной кислотой, то кривые, представленные на рис. 8 - 2 для этих интервалов концентраций H2SO4 являются приближенными. Из этого рисунка видно, что 98 3 % - ная серная кислота обладает наиболее высокой абсорбционной способностью. С понижением и повышением концентрации H2SO4 - степень абсорбции кислоты уменьшается тем более резко, чем выше температура кислоты. [14]
Таким образом отводится теплота реакции. Затем значительно увлажненный газ с содержанием фтора - 3 г на 1 м3 сухого воздуха вновь поступает в абсорбционную систему, где из него удаляется основная масса соединений фтора и водяного пара, а его температура вновь понижается за счет подачи на абсорбцию охлажденной гексафторокремниевой кислоты. [15]
Страницы: 1 2