Индольный ауксин
Cтраница 1
Индольные ауксины и фенольные ингибиторы образуются из общего метаболического центра - шикимовой кислоты, в то время как гиббереллины и абсцизовая кислота - из мевалоновой кислоты. [1]
Таким образом, индольные ауксины ( ИУК, индолацетонитрил и др.), также как и фенольные ингибиторы ( n - кумаровая кислота, кумарин, нарингенин и др.), образуются из общих предшественников - шикимовой и хоризмовой кислот. [2]
Нами получены данные о его действии на синтез индольных ауксинов из L-триптофана. Выше отмечалось, что КГК подавляет процесс превращения L-триптофана в индольные ауксины. Возможно, связь между этими классами регуляторов является более общей и основана на наличии общего предшественника - хоризмовой кислоты, от которой расходятся ветви биосинтеза ауксинов и фенольных ингибиторов. Детали этого механизма рассмотрены в предыдущей главе. [3]
В стерильных и полустерильных условиях ткани высшего растения способны превращать L-триптофан в индольные ауксины, однако содержание свободных ауксинов при этом остается достаточно низким. Присутствие в растительных тканях комплексов ИУК ( в особенности ИУК-глюкозы), дающих при электрофоретическом разделении ИУК, позволяют заключить, что и в высшем растении из L-триптофана образуется большое количество ИУК, которое подвергается дальнейшим превращениям. [4]
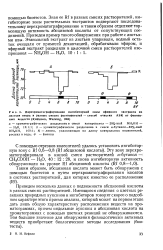 |
Перехроматографирование ингибиторной зоны эфирного экстракта из листьев явора в разных смесях растворителей - способ очистки АБК от феноль-ных веществ ( Robinson, Wareing, 1964. [5] |
Имеющиеся сведения о цветных реакциях природных ауксинов и ингибиторов говорят скорее о подсобном характере этого приема анализа, который может на первом этапе дать лишь общую характеристику расположения веществ на хро-матограммах, причем индольные ауксины и абсцизовая кислота на хроматограммах с помощью цветных реакций не обнаруживаются. [6]
Имеющиеся сведения о цветных реакциях на природные аукси-ны и ингибиторы говорят скорее о подсобном характере этого приема анализа, который может на первом этапе дать лишь общую характеристику расположения пятен на хроматограммах. Причем индольные ауксины и абсцизовая кислота на хроматограммах с помощью цветных реакций не обнаруживаются. [7]
Существование метаболических участков с разветвляющимися биосинтетическими ветвями тем более вероятно, что у противоположно действующих факторов ( фитогормонов и ингибиторов) имеются общие метаболические предшественники. Для индольных ауксинов и фенольных ингибиторов - шикимовая и хоризмовая кислоты, а для гиббереллинов и абсцизовой кислоты - мевалоно-вая кислота и ее производные. [8]
Йндольные соединений в высших растениях содержатся практически в количествах, обнаруживаемых только с помощью биотестов. В таком случае для обнаружения значений Rf индольных ауксинов на хроматограммах используют вещества-метчики, которые проявляются на хроматограммах с помощью указанных реактивов. [9]
Нами получены данные о его действии на синтез индольных ауксинов из L-триптофана. Выше отмечалось, что КГК подавляет процесс превращения L-триптофана в индольные ауксины. Возможно, связь между этими классами регуляторов является более общей и основана на наличии общего предшественника - хоризмовой кислоты, от которой расходятся ветви биосинтеза ауксинов и фенольных ингибиторов. Детали этого механизма рассмотрены в предыдущей главе. [10]
Следует еще раз подчеркнуть, что индольные соединения в тканях высших растений, взятых для анализа в количестве 0 1 - 1 г сухого вещества, обычно с помощью цветных реакций не обнаруживаются, поэтому такой способ идентификации годится для анализа индолов в культурах микроорганизмов, а для идентификации индолов в тканях высших растений необходимо использовать навески в 10 - 100 раз большие. Если подобного рода навески почему-либо применять неудобно, то для обнаружения значений индольных ауксинов на хроматограммах используют вещества-метчики, которые проявляются на хроматограммах с помощью указанных реактивов. [11]
Безусловно, говоря о вилках метаболизма гормональных и антигормональных соединений, нельзя не учитывать тесной связи ре-гуляторных соединений с классами аминокислот, белков, витаминов, пигментов. Так, например, в период активного роста растений идет быстрое превращение триптофана в индольные ауксины и одновременно происходит его включение в полипептиды и белки, в то время как осенью, при замедлении роста, этот путь тормозится и усиливается образование безазотистых соединений - лигнина, флавоноидов и фенольных ингибиторов. Гормональные соединения, по-видимому, регулируют синтез этих продуктов, что в конечном счете ведет к изменению темпов ростового процесса. [12]
Рутин, хлоррге-новая и галловая кислоты, флоридзип, морин при добавлении в культураль-ную срэДУ вызывали усиленный синтез индольных ауксинов грибом. [13]
На этапе биосинтеза природный ингибитор мог бы специфично блокировать образование фитогормона на уровне превращения предшественника. Так, в наших опытах природный ингибитор, выделенный из тканей гороха - кверцетин-глюкозил-кумарат - на 88 % подавлял синтез ИУК-производных и на 65 % тормозил превращение L-триптофана в индольные ауксины. [14]
С этой целью нами были выбраны две группы объектов: грибы Taphrina sadebeckii и Taphrina epiphylla, вызывающие у высших растений патологический рост, и гипокотили и культура тканей капусты. Концентрацию индольных ауксинов в среде определяли колориметрически после обработки среды реактивом Сальковского. [15]
Страницы: 1 2