Схематическая диаграмма - состояние
Cтраница 1
Схематическая диаграмма состояний приведена на фиг. [1]
Схематическая диаграмма состояний для вещества, имеющего три фазы - твердую, жидкую и газообразную - показана на рис. 10.5. Наклон кривой плавления АВ изображен для случая, когда плавление сопровождается уменьшением объема, как у льда. В отличие от кривой равновесия пара и жидкости Л / С, оканчивающейся при критической температуре в точке / С, кривая плавления АВ продолжается неограниченно. Кривая равновесия твердого тела с газом уходит в начало координат. Действительно, по законам классической механики при стремлении температуры к абсолютному нулю тепловое движение прекращается. Неподвижные атомы занимают такое расположение, при котором потенциальная энергия взаимодействия минимальна. Это расположение представляет собой регулярную пространственную решетку. Поэтому при абсолютном нуле температуры любое вещество с точки зрения классической механики должно быть кристаллическим. [2]
Схематическая диаграмма состояния Be-Yb построена в работе [1] методами термического, металлографического и рентгеновского анализа трех сплавов. [3]
Постройте схематическую диаграмму состояния систем А - б, компоненты которой образуют соединения АВ3, АВ и А3В, причем первое и третье совершенно не диссоциируют в расплаве, а второе подвергается частичной диссоциации при плавлении. [4]
Постройте схематическую диаграмму состояния системы А-В, имеющей одну эвтектическую точку и инконгруэнтно плавящееся соединение Л25, но не имеющей твердых растворов. [5]
Конечно, схематическая диаграмма состояния, приведенная на рис. 1.2, не отражает всех сложных случаев лиотропных жидкокристаллических систем даже для низкомолекулярных компонентов. Дело, в частности, в том, что кроме фактора асимметрии в образовании некоторых жидкокристаллических систем существенную роль играет и межмолекулярное взаимодействие, и особенно геометрия размещения в молекуле взаимодействующих групп. Так, для мыл ( солей жирных кислот с длинными углеводородными хвостами) способность образовывать лиотропные жидкокристаллические системы связана с дифильностью молекул, в результате которой при взаимодействии с водой по месту лиофильных кислотно-солевых групп происходит специфическая слоевая упаковка молекул с размежеванием лиофильных и лиофобных групп. Определенные количественные соотношения между сорбируемыми молекулами растворителя ( воды) и лиофильными группами обусловливают возможность образования нескольких участков на диаграмме состояния, отвечающих различным структурам жидких кристаллов. [6]
Флерке [19] приводит схематическую диаграмму состояния кремнезема, в которой принимаются только две модификации Si02: кварц и кристобалит. [7]
Этот эффект иллюстрируется схематической диаграммой состояния фиг. [8]
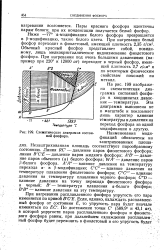 |
Схематическая диаграмма состояний фосфора. [9] |
На рис. 199 изображена схематическая диаграмма состояний фосфора в координатах давление - температура. Эта диаграмма выполнена не в масштабе и показывает лишь характер влияния температуры и давления на переход фосфора из одной модификации в другую. [10]
В работе [1] была приведена схематическая диаграмма состояния системы Yb - Sb, предусматривающая наличие химических соединений Yb. Sb, Yb4Sbs, YbSb и YbSbj, плавящихся конгруэнтно при 1440, 1450, 1500 и 1000 соответственно и вступающих в эвтектические реакции между собой, а наиболее богатые одним из компонентов - с соответствующим компонентом. [11]
Этих данных достаточно для построения схематической диаграммы состояния воды. Количественные данные, характеризующие эти равновесия, дают возможность построить точную диаграмму. [12]
При 0 0075 С вода образует однокомпонентную трехфазную систему, состоящую из ее паров, жидкой воды и льда. Подобное равновесие в системе характеризуется так называемой тройной точкой диаграммы состояния, показывающей, в каком фазовом состоянии находится вещество в зависимости от давления и температуры. Для построения диаграммы состояния вещества используют пря мо-угольную систему координат, откладывая по оси абсцисс абсолютную температуру, а по оси ординат давление. Найденные значения температуры и давления являются координатами точки, местоположение которой на диаграмме показывает фазовое состояние вещества при данных условиях. Как видно из схематической диаграммы состояния воды, приведенной на рис. 56, вся ее площадь разделена на три зоны, отвечающие трем фазовым состояниям. Переходу воды в переохлажденное состояние соответствует кривая OD, являющаяся продолжением кривой ОС за точку О - точку замерзания воды. [13]
Страницы: 1