Ацетилсульфат
Cтраница 1
Ацетилсульфат легко сульфирует ароматические углеводороды с минимальным образованием сульфонов, как отмечается в гл. Он также применяется для сульфирования гетероциклических соединений. [1]
Давно известно, что бензол сульфируется ацетилсульфатом [306], однако этот способ лишь недавно нашел применение для снижения количества образующихся сульфонов. [2]
Уксусный ангидрид реагирует с серной кислотой, а уксусная кислота с S03 с образованием ацетилсульфата ( см. гл. Однако выход ее невелик, и метод не может быть рекомендован для препаративных целей. При изучении кинетики и механизма этой реакции [210] установлено, что конверсия моно - и диаце-тилсульфатов в сульфокислоту определяет общую скорость реакции. [3]
Ароматические полимеры легко сульфируются концентрированной серной кислотой, хлорсульфоновой кислотой, чистым ( или в виде комплексов) триоксидом серы или ацетилсульфатом. [4]
Реакцию проводят в мягких условиях ( 293 К, 20 мин) в углеводородном растворителе в присутствии комплекса SO3 - триэтилфосфат, ацетилсульфатов и других сульфирующих агентов. Аналогично процессу галогенирования модифицируются изопренильные звенья; 8О3Н - группы находятся Б аллильном положении к двойным связям. Полимерный продукт содержит 0 5 - 1 5 % ( мол. По мере их нейтрализации NaOH возрастает жесткость, каркасность и когези-онная прочность каучука, а при содержании SO3Na - rpynn более 0 6 % ( мол. [5]
Реакцию проводят в мягких условиях ( 293 К, 20 мин) в углеводородном растворителе в присутствии комплекса 8О3 - триэтилфосфат, ацетилсульфатов и других сульфирующих агентов. Полимерный продукт содержит 0 5 - 1 5 % ( мол. По мере их нейтрализации NaOH возрастает жесткость, каркасность и когезионная прочность каучука, а при содержании SO3Na - rpynn более 0 6 % ( мол. [6]
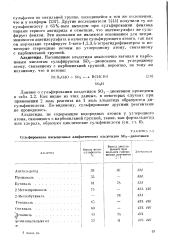 |
Сульфирование насыщенных алифатических альдегидов SOg-днокеаном. [7] |
Другие исследователи [444] получили ту же сульфокислоту с 65 % - ным выходом при сульфировании фенхона парами серного ангидрида и отметили, что ацетилсульфат не сульфирует фенхон. Эти аномалии не являются основанием для неприменимости ацетилсульфата в качестве сульфирующего агента, так как он нормально сульфирует 1-кето - 1 2 3 4-тетрагидрофенантрен и некоторые стероидные кетоны по углеродному атому, связанному с карбонильной группой. [8]
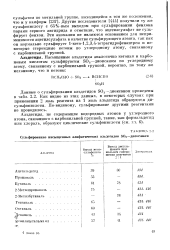 |
Сульфирование насыщенных алифатических альдегидов SOg-днокеаном. [9] |
Другие исследователи [444] получили ту же сульфокислоту с 65 % - ным выходом при сульфировании фенхона парами серного ангидрида и отметили, что ацетилсульфат не сульфирует фенхон. Эти аномалии не являются основанием для неприменимости ацетилсульфата в качестве сульфирующего агента, так как он нормально сульфирует 1-кето - 1 2 3 4-тетрагидрофенантрен и некоторые стероидные кетоны по углеродному атому, связанному с карбонильной группой. [10]
В качестве сульфирующего агента для кетонов хорошо себя зарекомендовал S03 - диоксан, применяемый в присутствии 1 2-дихлорэтана как растворителя при 5 - 50 С. В некоторых случаях [452] сульфокислота осаждается уже при охлаждении реакционной смеси. Ацетилсульфат применяется главным образом для сульфирования дикетонов и стероидных кетонов; сульфирование этим реагентом может быть проведено более мягко и селективно, чем с хлорсульфоновой кислотой. [11]
Реакция образования а - СКК - двухстадийна: вначале образуется так называемый смешанный ангидрид ( ацилсульфат), а затем происходит внутримолекулярная перегруппировка, его в а - СКК. Это доказано, по крайней мере, для низших жирных кислот. Так, образующийся при сульфировании уксусной кислоты ацетилсульфат выделен при 0 С и идентифицирован. Необходимо отметить, что ее образование даже в таких сравнительно мягких условиях сопровождается, осмолением и выделением двуокиси серы. [12]
Для сдвига равновесия вправо применяют избыток Н28О4 либо удаляют воду отгонкой или с помощью дегидратирующих агентов. При переходе от первичных к вторичным спиртам скорость р-ции снижается на порядок. Метод непригоден для получения треот-алкилсульфатов. Сульфатирование с помощью 8О3 ( КОН 8О3 - КО8О2ОН) осуществляется либо его парами, либо в инертных р-рителях ( СС14, 8О2, С82 и др.), или комплексами. В качестве сульфатирующих агентов используют также галогенсульфоновые к-ты, сульфаминовую к-ту или ацетилсульфат. [13]
Сведения об этой реакции приведены в табл. 2.1. Если R метил, a R алкил, то замещение происходит в СН. Даже кетоны с третичными углеродными атомами, такие, как диизопропил-кетон, сульфируются с хорошим выходом. Пивалофенон не сульфируется, что объясняется отсутствием водородного атома у углеродного атома, связанного с карбонильной группой. Среди других кетонов, содержащих карбоциклические ядра, сообщается о сульфировании в ядро 2-ацетонафтона и 2 - ( 3 4 -ди-метоксифенил) - 1 3-индандиона. В последнем случае это не является неожиданным, так как известно, что ароматическое ядро очень легко сульфируется при наличии двух метоксильных групп. Фе-нил - 1 3-индандион и родственные соединения сульфируются в ядро исключительно хлорсульфоновой кислотой в галогенсодержащем растворителе, однако желаемое соединение ( сульфокислота по соседнему с карбонильной группой углероду) получается с более мягко реагирующими ацетилсульфатом или C1S03H в диэтиловом эфире. [14]
Страницы: 1