Ацидокомплекс
Cтраница 2
Получение ацидокомплексов в принципе несложно и сводится к взаимодействию соли одного металла с солью или кислотой другого, взятых в определенных соотношениях. [16]
Устойчивость ацидокомплексов зависит от химической природы лиганда и центрального атома. [17]
Из ацидокомплексов Э ( 1) наиболее устойчивы цианидные. [18]
Из ацидокомплексов Э () наиболее устойчивы цианидные. [19]
Образование ацидокомплексов металлов зависит также от природы аддендов, что является одним из условий избирательной экстракции металлов аминами. [20]
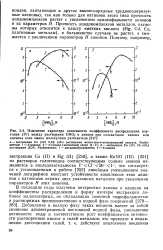 |
Изменение характера зависимости коэффициента распределения плутония ( IV между растворами НМО3 и аминов при сольватации аниона или катиона соли амина молекулами разбавителя. [21] |
Прочность ацидокомплексов металлов, катионы которых относятся к классу мягких кислот ( Hg, Cd, Co, платиновые металлы), в большинстве случаев не растет, а снижается с увеличением параметров Я анионов. [22]
Экстракция ацидокомплексов металлов в виде соединений с органическими основаниями проходит обычно в кислых средах при избытке анионного ли-ганда. В этих условиях органическое основание находится в виде соли с соответствующим анионным лигандом, и экстракционное поведение такой соли будет существенно сказываться на извлечении металлокомплексных анионов. [23]
Экстракция ацидокомплексов металлов в виде соединений с органическими основаниями проходит обычно в кислых средах при избытке анионного ли-ганда. В этих условиях органическое основание находится в виде соли с соответствующим анионным лигандом, и экстракционное поведение такой соли будет существенно сказываться на извлечении металлокомплексных анионов. [24]
Однако относить ацидокомплексы к разряду двойных солей следует с осторожностью, так как при замене растворителя может и не происходить полной диссоциации соли на отдельные ионы. Так, типичная двойная соль - алюмокалиевые квасцы - легко распадается в водном растворе на ионы К, А13 и SO -, но в среде ацетона обнаруживаются комплексные анионы [ А. [25]
Аммины, Ацидокомплексы, Гетерополисоеди-нения, Карбонилы металлов и др. О л-комплексах см. Ме-таллоорганические соединения. [26]
Механизм образования ацидокомплексов из простых молекул по существу схож с таковым для других комплексных соединений и заключается в перетягивании атомов ( ионов) без образования новых электронных пар, а с использованием существующих. [27]
Координационные числа ацидокомплексов постоянны для элементов одного и того же периода, но возрастают с увеличением номера периода ( увеличение радиуса атома-неметалла. [28]
Как среди ацидокомплексов, так и среди молекулярных комплексов существуют соединения, содержащие во внутренней сфере разные ацидолиганды и разные нейтральные лиганды. Так, для металлов VIII группы периодической системы нередки случаи, когда во внутренней сфере находятся кислотные остатки двух или более кислот. В растворах особенно часто встречаются смешанные молекулярные координационные соединения, одним из лигандов в которых являются молекулы растворителя. [29]
Основная масса ацидокомплексов содержит Мп, Тс и Re в низших степенях окисления, которые при комплексообразовании стабилизируются, как, например, в цианидных комплексах рения: [ Re. Неустойчивый МпСЦ при взаимодействии с КС1 превращается в стабильный К2 [ Мп1уС1б ], выделяющийся из раствора в виде темно-красных кристаллов. Цианид марганца ( III) неизвестен, но темно-красные кристаллы RbsfMn ( CN) e ] устойчивы. Фторид Мп ( Ш) в водном растворе подвеогается гидролизу и диспропорционированию, а комплексы K [ Mn F4 ] и K2 [ Mn PS ] кристаллизуются без изменения их состава. [30]
Страницы: 1 2 3 4