Аяобра
Cтраница 1
Расчет АЯобр в общем случае производят следующим путем. Выбирают вещество, лежащее в основе рассматриваемого соединения, находят для него АЯ0бр и добавляют поправки, являющиеся результатом всех замещений водородных атомов группами СН3, необходимых для построения углеродного скелета. При этом рекомендуется построить наиболее длинную прямую цепь, а затем наиболее длинную боковую цепь. Если одно и то же соединение может быть получено различными замещениями, то берется средний результат. Затем вносятся поправки на связи и на замещение групп СН3 другими группами. [1]
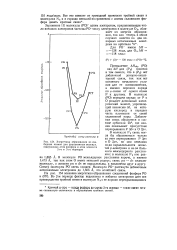 |
Энергетика образования из свободных атомов для двухатомных молекул, содержащих атом фосфора и атом элемента 2-го и 3-го периодов. [2] |
Превышение АЯобр ( РО) над АЯ для ( Р2) понятно в том смысле, что в ( Р2) нет добавочной донорно-акцеп-торной связи, так как нет основного начального условия для ее возникновения, а именно переноса заряда по а-связи от одного атома Р к другому. В молекуле ( РО) передача заряда от Р к О рождает дипольный электрический момент, упрочняющий вакансию 3d, на которую кислород и передает часть плотности от своей уединенной пары. Добавочная связь образуется в составе орбитали 2я4, где анализ показывает присутствие перекрывания Р 3dir и О 2 / те. В молекуле Р2 связь могла бы образоваться только за счет перекрывания Р 3 / ж и О 2 / ж, но оно невелико из-за параллельности лопастей р-электрона и из-за большого межъядерного расстояния; в молекуле Р2 оно равно 1 885 А. В молекуле РО межъядерное расстояние короче, а именно 1 473 А, так как атом О имеет меньший радиус; связь ря - dir сжимает молекулу, а лопасти рл и dis не параллельны, а наклонены друг к другу. Спектр молекулы РО очень сложен. Молекула РО растянута добавочным антисвязевым электроном до 1 505 А, что ослабляет связь. [3]
Методы определения АЯобр путем прямого синтеза ( или разложения) бинарных соединений, а также солей в калориметрической бомбе имеют определенные преимущества перед методами, основанными на использовании закона Гесса. В случае бинарных соединений эти последние методы заключаются обычно в сожжении или растворении в подходящем растворителе как соединения, так и соответствующей смеси простых веществ. В случае солей кислородных кислот ( вольфраматы, цирконаты) измеряемая величина АЯ Р намного больше, чем АЯо6р бинарных соединений, но и в этом случае метод синтеза более экономен, так как при вычислении ДЯобр по закону Гесса приходится пользоваться системами термохимических уравнений, требующими знания ЬН нескольких ( а иногда и многих) реакций. [4]
Теплота образования дициана АЯобр ( C2N2, газ) была определена недавно 219 ]; она равна 73 84 0 43 ккал / моль, что дает величину D ( NC-CN), равную 112 ккал / моль. Таким образом, была установлена величина энергии диссоциации, относительно которой было столько различных мнений. [5]
Сравнения вычисленных значений АЯобр цикланов С Н2га ( п & 3) с экспериментальными показывают, что, лишь начиная с циклопентана ( п 5), значения практически совпадают друг с другом; для п 3 и 4 экспериментальные величины АЯобр больше теоретических. [6]
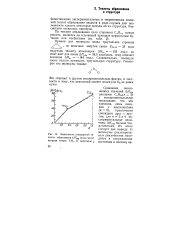 |
Зависимость стандартной теплоты образования ДЯ298 ( ккал. моль нитрида титана TiN от величины х. [7] |
ДЯат - 105 ккал; но опыт дает для озона АЯобр 34 5 ккал. [8]
АЯатомиз - - 105 ккал; но опыт дает для озона АЯобр 34 0 ккал / моль, чему отвечает значение ДЯатомиз 145 ккал. [9]
Сравнения вычисленных значений АЯобр цикланов С Н2га ( п & 3) с экспериментальными показывают, что, лишь начиная с циклопентана ( п 5), значения практически совпадают друг с другом; для п 3 и 4 экспериментальные величины АЯобр больше теоретических. [10]
При термохимических расчетах широко используется понятие теплоты образования АЯобр. Теплота образования - это теплота, которая выделяется при образовании сложного вещества из простых веществ. Теплоты образования простых веществ, устойчивых при 25 С и давлении 0 1 МПа, приняты равными нулю. [11]
При термохимических расчетах широко используют понятие теплоты образования АЯобр. Теплота образования - это теплота, которая выделяется при образовании сложного вещества из простых веществ. Теплоты образования простых веществ, устойчивых при 25 С и давлении ОД МПа, приняты равными нулю. [12]
Публикации [7828-7884] посвящены неорганическим веществам. В исследованиях С. А. Щука-рева [7838-7842] развит метод изоатом расчета АЯобр. [13]
Надо иметь в виду, что для многих соединений значения АЯобр неизвестны или определены лишь для газообразного и жидкого состояний. [14]
Энергия сублимации соединения влияет на прочность этого соединения в обратном направлении по сравнению с энергией атомизации простых веществ: чем больше ( по абсолютной величине) энергия сублимации, тем больше энергии выделится при переходе от газообразного вещества к твердому, следовательно, тем экзотермичнее будет твердое вещество. Так же, но в более слабой степени, на суммарную величину АЯобр влияет энергия испарения жидкого соединения. [15]
Страницы: 1 2