Аяраст
Cтраница 1
АЯраст 0, так как не нужно затрачивать энергию на разрушение структуры газа, которой не существует. Поэтому растворение газов всегда является экзотермическим процессом. [1]
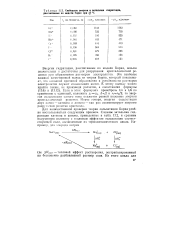 |
Свободные энергии и энтальпии гидратации, рассчитанные по модели Берна при 2JJ С. [2] |
АЯраст - тепловой эффект растворения, экстраполированный на бесконечно разбавленный раствор соли. [3]
 |
Расчетные значения активностей ( в молярных долях, %, коэффи испарения для Н20 и HP.| Политерма - изобара двухкомпонентной системы. [4] |
Кпп, , ДЯраст, но АЯраст не является функцией концентрации. [5]
 |
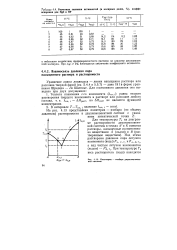
Зависимость теплоты растворения H2SO4 ( ж в Н2О ( ж при 25 С от числа молей воды пНг0. [6] |
В связи с этим следует обратить внимание на зависимость АЯраста от концентрации раствора. [7]
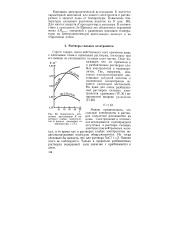 |
Зависимость константы диссоциации К некоторых слабых электролитов в водных растворах от температуры t ( C. [8] |
Константа электролитической диссоциации К является характерной величиной для данного электролита и растворителя и зависит лишь от температуры. Для многих веществ К проходит через максимум. В соответствии с принципом Ле Шателье это объясняется переменой знака АЯраст, связанной с различным влиянием температуры на электролитическую диссоциацию молекул и на гидратацию ионов. [9]
Страницы: 1