Масса - железо
Cтраница 4
Далее строят градуировочный график для определения железа. Для этого берут 3 - 4 аликвоты стандартного раствора железа, помещают в мерные колбы вместимостью 50 мл, куда добавляют 5 мл раствора сульфосалициловой кислоты, 4 мл 25 % - го раствора аммиака и воду до метки. Перемешивают растворы и измеряют оптическую плотность стандартных растворов железа. Аликвоты выбирают таким образом, чтобы оптическая плотность стандартных растворов была как меньше, так и больше оптической плотности исследуемого раствора. По полученным данным строят градуировочный график в координатах оптическая плотность - содержание железа, мг и, пользуясь им, рассчитывают массу железа в анализируемой смеси в граммах. [46]
Анализируемый раствор, представляющий собой смесь солей железа и никеля, в колбе вместимостью 100 мл доводят до метки водой. Сначала берут пипеткой 20 мл в мерную колбу вместимостью 50 мл, добавляют 5 мл НС1 и доводят до метки водой. В другую такую же колбу берут 20 мл исследуемого раствора, добавляют 5 мл НС1, 5 мл тиоцианата калия ( аммония) и доводят водой до метки. Находят АА А - А0 и с помощью градуировочного графика определяют концентрацию железа. Рассчитывают массу железа в исследуемом растворе в миллиграммах, учитывая все произведенные разбавления. [47]
 |
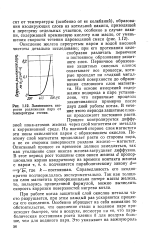
Кривая фотометрического титрования смеси железа ( Ш и меди ( Н раствором ЭДТА. [48] |
Исследуемый раствор, содержащий смесь FeQ3 и CuSO4, помещают в колбу вместимостью 50 мл, добавляют 5 мл НС1, доводят до метки водой и тщательно перемешивают. Отбирают пипеткой 20 мл полученного раствора, помещают в стакан вместимостью 100 мл и добавляют из бюретки 30 мл воды. Настраивают оптический прибор, как указано в описании. Затем помещают стакан с анализируемым раствором в кюветное отделение, включают мешалку и титруют раствором ЭДТА, приливая его порциями по 0 20 мл из микробюретки. Через 20 - 30 с после добавления каждой порции записывают значения оптической плотности А. В начале титрования оптическая плотность изменяется очень незначительно. Титрование продолжают до тех пор, пока изменение оптической плотности после быстрого роста вновь станет незначительным. Строят график в координатах оптическая плотность - объем ЭДТА. На кривой титрования находят две точки эквивалентности. Рассчитывают массу железа и меди в исследуемом растворе в миллиграммах, учитывая произведенные разбавления. [49]
 |
Зависимость скорости разложения пара от температуры стенки. [50] |
Окисление железа перегретым паром и водой высокой чистоты детально исследовано; при его протекании целесообразно различать первичное и постоянное образование защитного слоя. Первичное образование защитных окисных пленок охватывает все процессы, которые проходят на гладкой металлической поверхности до образования сплошного слоя магнетита. На основе измерений содержания водорода в паре установлено, что первичные процессы заканчиваются примерно после двух дней работы котла. В течение этого периода защитные пленки продолжают постоянно расти. Процесс контролируется диффузией иона-атомов железа через слой магнетита от металла к коррозионной среде. На внешней стороне слоя магнетита эти ионы окисляются паром с образованием окислов. Поэтому слой магнетита продолжает расти со стороны пара, а не со стороны поверхности раздела железо - магнетит. Описанный процесс со временем должен замедляться, так как утолщение слоя окисла железа затрудняет диффузию. Справедливость его неоднократно подтверждалась экспериментально. Так как толщина слоя магнетита пропорциональна потере массы железа, то, пользуясь приведенной формулой, можно вычислить скорость коррозии поверхностей нагрева котла. [51]
По мере заряда и обогащения оксидов кислородом их активность увеличивается и стационарный потенциал электрода возрастает. Потенциал NiOOH в растворе щелочи по отношению к водородному электроду в том же растворе лежит в пределах 1 3 - 1 43 В. Хорошо заряженные оксидно-никелевые электроды после прекращения заряда постепенно выделяют кислород, и потенциал их падает. В растворах щелочи более высокой концентрации заряд оксидно-никелевого электрода происходит полнее, улучшается использование никеля в активной массе, но она начинает сильнее разбухать при циклировании. Это не всегда допустимо, так как масса начинает сильнее вымываться из ламелей и при разбухании электрода уменьшается расстояние между электродами, что усиливает опасность образования коротких замыканий. Токоотводящая добавка графита к активной массе наиболее важна в случае необходимости работы с повышенной плотностью тока. В массах, предназначенных для такой цели, процент графита желательно увеличивать. Большую роль играет вальцевание активной массы с графитом, при этом контакт графита с частицами оксидов никеля улучшается и использование никеля повышается. Слишком интенсивное вальцевание массы вызывает, однако, ее дробление и усиление оплывания из ламелей. Оксиды никеля ( N1OOH) очень чувствительны к, действию примесей и к составу электролита. Они способны частично замещать водород на другие катионы. Сильнее всего идет поглощение лития, затем натрия и калия. Старение активной массы, связанное с укрупнением кристаллов NiOOH, замедляется в присутствии лития и наиболее проявляется в калиевом электролите. Кроме лития, полезными являются также добавки к активной массе бария и кобальта. Попадание в массу железа, магния и алюминия ухудшает ее работу. [52]
Страницы: 1 2 3 4