Эквивалентная молекулярная масса
Cтраница 1
Эквивалентная молекулярная масса является эмпирической функцией, отражающей особенности группового состава углеводородов, входящих в состав природных газоконденсатных смесей. Для изопарафинов и оле-финов эквивалентная молекулярная масса приравнивается к молекулярной массе нормального ( парафинового углеводорода, температура кипения которого равна температуре кипения данного изопарафинового или олефинового углеводорода. [1]
Эквивалентную молекулярную массу ароматических нафтеновых углеводородов, а также фракций группы С5 определяют по графикам Органика, используя температуру кипения i характеристический фактор этих углеводородов. Однако этт графики выполнены в мелком масштабе. [2]
Эквивалентную молекулярную массу ароматических и нафтеновых углеводородов, а также фракций группы С5 определяют по графикам Органика, используя температуру кипения и характеристический фактор этих углеводородов. Однако эти графики выполнены в мелком масштабе. Поэтому чаще применяют другой способ определения эквивалентной молекулярной массы. [3]
 |
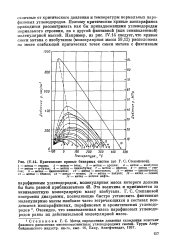
Критические кривые бинарных систем.| Зависимость эквивалентной молекулярной массы от действительной для углеводородов. [4] |
После вычисления эквивалентной молекулярной массы псевдокомпонента определение критической кривой сводится к следующему. Выбирают два ближайших нормальных парафиновых углеводорода с молекулярными массами больше и меньше, чем у псевдокомпонента. Точки искомой критической кривой находят путем линейной интерполяции по молекулярной массе при различных температурах. [5]
Для изопарафинов и олефинов эквивалентную молекулярную массу приравнивают к молекулярной массе нормального парафинового углеводорода, температура кипения которого равна температуре кипения данного изопарафинового или олефинового углеводорода. [6]
Для изопарафинов и олефинов эквивалентную молекулярную массу приравнивают к молекулярной массе нормальною парафинового углеводорода, температура кипения которого рази а температуре кипения данного изопарафинового или олефиною. [7]
Эта величина и принимается за эквивалентную молекулярную массу изобутана. Очевидно, что эквивалентная масса парафиновых углеводородов равна их действительной молекулярной массе. [9]
 |
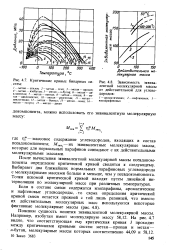
Зависимость разности между истинной критической и исевдокрнтической температурами от мольного содержания метана в бинарных смесях его с парафиновыми углеводородами ( по Г.С.Степановой / 24 /. [10] |
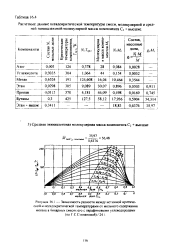
Расчетные данные псевдокригической температуры смеси, молекулярной и средней эквивалентной молекулярной массы компонента Сг высшие. [11]
Таким же образом следует поступать при определении эквивалентной молекулярной массы фракции конденсата и нефти. [12]
Поскольку температуры кипения изобутана и изопентана находятся, между температурами кипения пропана и н-бутана, то эквивалентную молекулярную массу этих изопарафинов лучше определять так же, как и фракций остатка. [13]
Для сильных кислот или оснований и для кислот или оснований, имеющих только один реакционноспособный ион водорода или гидроксил-ион, соотношение между эквивалентной и молекулярной массой определить легко. Например, эквивалентные массы гидроксида калия и хлорной кислоты должны быть равны их молекулярным массам, поскольку в каждом из них имеется один реакционноспособный гидроксил-ион или ион водорода. Аналогично, мы знаем, что в молекуле уксусной кислоты НСгНзОз может отщепляться только один ион водорода, поэтому молекулярная и эквивалентная массы этого вещества идентичны. Гидроксид бария Ва ( ОН) 2 является сильным основанием, содержащим два неразличимых гидроксил-иона. Поскольку в любой кислотно-основной реакции это основание реагирует с двумя ионами водорода, его эквивалентная масса равна половине молекулярной массы. [14]
По методике Г. С. Степановой далее из этой точки проводят две кривые эквидистантно двум критическим кривым бинарных смесей метана с углеводородами, молекулярные массы которых наиболее близки к средней эквивалентной молекулярной массе компонента С2 высшие. И далее интерполяцией между построенными кривыми при данной критической температуре определяют ркр смеси по значению Мэкв компонента С2 высшие. [15]
Страницы: 1 2