Мольные массы
Cтраница 3
Мольные массы водорода и кислорода находим по справочнику: MH. [31]
 |
Газовая пипетка - прибор для отбора точного объема газа. [32] |
На основании закона Авогадро появилась возможность определения мольных масс тех веществ, которые могут быть переведены в газообразное состояние. Поскольку мольные массы численно равны относительным молекулярным массам, то обычно говорят, что таким путем определяют молекулярные массы веществ. [33]
Многие элементы образуют по нескольку соединений с водородом или кислородом и обладают поэтому несколькими значениями мольных масс своих эквивалентов. При этом мольные массы эквивалентов одного и того же элемента относятся друг к другу как небольшие целые числа, а атомная масса элемента равна одной из мольных масс его эквивалента или больше ( меньше) ее в небольшое целое число раз. [34]
Наличие внешних полей ( гравитационного, центробежного, электрического) вносит своеобразие в картину кондуктивного переноса масс компонентов. Это своеобразие наиболее отчетливо проявляется тогда, когда мольные массы компонентов, а значит и массы принадлежащих к ним частиц, существенно отличаются друг от друга. Така я ситуация возникает, например, в растворах высокомолекулярных соединений в обычном жидком растворителе. Сходные явления наблюдаются при переносе коллоидных частиц в дисперсионной среде. Хотя в последнем случае система и является гетерогенной, тем не менее с молекулярно-кинетической точки зрения она вполне может быть уподоблена раствору, в котором роль растворителя играет дисперсионная среда, а роль растворенного вещества - множество частиц дисперсной фазы. [35]
Наличие внешних полей ( гравитационного, центробежного, электрического) вносит своеобразие в картину кондуктивного переноса масс компонентов. Это своеобразие наиболее отчетливо проявляется тогда, когда мольные массы компонентов, а значит и массы принадлежащих к ним частиц, существенно отличаются друг от друга. Такая ситуация возникает, например, в растворах высокомолекулярных соединений в обычном жидком растворителе. Сходные явления наблюдаются при переносе коллоидных частиц в дисперсионной среде. Хотя в последнем случае система и является гетерогенной, тем не менее с молекулярно-кинетической точки зрения она вполне может быть уподоблена раствору, в котором роль растворителя играет дисперсионная среда, а роль растворенного вещества - множество частиц дисперсной фазы. [36]
Поскольку в составленном уравнении две неизвестные величины, то для однозначного решения задачи необходимо составить еще одно уравнение, в котором будут фигурировать эти же неизвестные. С этой целью воспользуемся тем, что массы любых двух веществ, уча ствующих в реакции, относятся как мольные массы этих веществ, умноженные на коэффициенты, стоящие в уравнении реакции перед их формулами. [37]
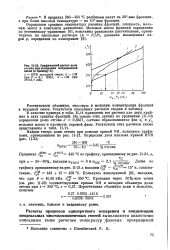 |
Графический расчет доли отгона при испарении непрерывной смеси ( к примеру 8. [38] |
В качестве примера в табл. - 11 11 приведены все расчеты для двух крайних и двух средних фракций. На основе этих данных по уравнению (11.53) определяем долю отгона е 0 3557, составы образовавшихся фаз х и y it мольные массы и плотность паровой фазы. [39]
Подчеркнем: в полученных формулах для граничных потоков могут фигурировать и массовые величины - потоки фаз и концентрации. Кстати, при полной конденсации пара в конденсаторе значения флегмового числа R в мольных и массовых единицах совпадают, так как составы, а значит, и мольные массы дистиллята и флегмы одинаковы. [40]
Уравнения ( 31) определяют общие условия равновесия в системе, состоящей из N компонентов и Z фаз, при условии, что каждый компонент присутствует во всех фазах. Для каждой фазы в соответствии с уравнением ( 26) на первый взгляд кажется, что имеется ( N - - 2) независимых переменных; но если все мольные массы компонентов увеличатся в равной степени, то не произойдет ни изменения состава, ни изменения состояния, а только изменение общего количества. [41]
Так как понижение температуры замерзания ( и повышение температуры кипения) раствора изменяется пропорционально моляльной концентрации, а один моль любого вещества содержит одинаковое число молекул, то Л T3am зависит только от числа частиц растворенного вещества. Это есть следствие из закона Рауля: понижение температуры замерзания раствора ( и повышение его температуры кипения) пропорционально числу частиц растворенного вещества. Из этого следует, что методами криоскопии и эбулиоскопии можно определять мольные массы неэлектролитов, степень диссоциации электролитов и степени ассоциации ( соединения) молекул растворенных веществ. [42]
Страницы: 1 2 3